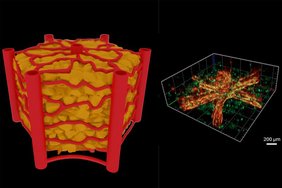
Allerdings stößt man dabei auf ein großes Problem: Solche Mini-Organe sind unvollständig ohne Blutgefäße. Um eine echte Vergleichbarkeit mit lebenden Organismen sicherzustellen, muss man ein lebensnahes Netz winziger durchflussfähiger Blutgefäße und Kapillaren erzeugen – und zwar auf genau kontrollierbare, reproduzierbare Weise. Genau das ist an der TU Wien nun gelungen: Man entwickelte ein neues Verfahren, bei dem mit Hilfe ultrakurzer Laserpulse in kurzer Zeit auf reproduzierbare Weise winzige Blutgefäße entstehen. Versuche zeigen: Diese Gefäße verhalten sich tatsächlich so wie Gefäße im lebenden Gewebe. Leber-Gewebe wurde mit großem Erfolg auf einem Chip hergestellt.
Echte Zellen in künstlichen Kanälchen
„Wenn man beispielsweise untersuchen möchte, wie bestimmte Medikamente in unterschiedlichen Geweben transportiert und absorbiert werden, dann braucht man feinste Netze aus Blutgefäßen“, sagt Alice Salvadori, die in der Arbeitsgruppe von Prof. Aleksandr Ovsianikov am Institut für Werkstoffwissenschaft und Werkstofftechnologie der TU Wien forscht.
Idealerweise werden solche Blutgefäße in speziellen Materialien hergestellt, in sogenannten Hydrogelen. Diese Materialien bieten den lebenden Zellen Halt, sind aber durchlässig, ähnlich wie natürliche Gewebe. Wenn man in solchen Hydrogelen kleine Kanälchen erzeugt, kann man erreichen, dass sich im Inneren dieser Kanälchen sogenannte Endothelzellen anlagern – Zellen, die in unserem Körper das Innere von Blutgefäßen auskleiden. Damit hat man ein künstliches Modell erzeugt, das einem lebenden Blutgefäß sehr ähnlich ist.
Die große Schwierigkeit dabei ist allerdings: Form und Größe solcher Blutgefäß-Netzwerke sind schwer zu kontrollieren. Wenn die Netzwerke sich frei entwickeln, variiert die Geometrie der Blutgefäße immer stark von einer Probe zur anderen. Damit lassen sich keine reproduzierbaren, exakten Experimente durchführen – doch gerade das ist für präzise medizinische Forschung wichtig.
Besseres Hydrogel und Laser-Präzision
An der TU Wien setzte man daher auf eine hochentwickelte Lasertechnik: Mit Hilfe ultrakurzer Laserpulse mit einer Dauer im Femtosekunden-Bereich kann man in Hydrogelen sehr schnell und sehr effizient hochpräzise 3D-Strukturen in das Material hineinschreiben.
„Wir können auf diese Weise Kanäle herstellen, die nur hundert Mikrometer voneinander entfernt sind. Das ist essenziell, wenn man die natürliche Dichte von Blutgefäßen in bestimmten Organen replizieren möchte“, sagt Aleksandr Ovsianikov.
Doch nicht nur die exakte Herstellung der gewünschten Blutgefäß-Geometrie ist wichtig, die Blutgefäß-Netzwerke müssen vor allem stabil bleiben, wenn sie von Zellen besiedelt werden. „Wir wissen, dass Zellen ihre Umgebung verändern können. Das kann zu Verformungen führen, oder sogar zur Verstopfung von Blutgefäßen“, sagt Alice Salvadori. „Daher haben wir die Material-Präparation verbessert.“
Anstelle des üblichen einstufigen Gelierungsverfahrens verwendete das Team einen zweistufigen thermischen Härtungsprozess: Das Hydrogel wird in zwei Phasen mit unterschiedlichen Temperaturen erwärmt, nicht nur in einer. Dadurch verändert sich seine Netzwerkstruktur, und ein stabileres Material entsteht. Die Gefäße bleiben offen und behalten ihre Form über einen längeren Zeitraum bei.
„Wir haben nicht nur gezeigt, dass wir künstliche Blutgefäße herstellen können, die tatsächlich durchflossen werden können. Noch wichtiger ist: Wir haben eine skalierbare Technologie entwickelt, die im industriellen Maßstab eingesetzt werden kann“, sagt Aleksandr Ovsianikov. „Die Strukturierung von 30 Kanälen dauert nur 10 Minuten, was mindestens 60-mal schneller ist als andere Techniken.“
Eine Entzündung am Chip: Blutgefäße verhalten sich ganz natürlich
Wenn biologische Prozesse mit solchen Chips nachgestellt werden sollen, muss man zunächst sicherstellen, dass sie sich tatsächlich so verhalten wie natürliches Gewebe. Und das konnte das Team nun tatsächlich nachweisen: „Wir haben gezeigt, dass diese künstlichen Blutgefäße tatsächlich mit Endothelzellen besiedelt werden, die genauso reagieren wie Endothelzellen im Körper“, sagt Alice Salvadori. „Sie reagieren beispielsweise auf dieselbe Weise auf Entzündungen – sie werden dabei durchlässiger, genau wie Blutgefäße im Körper.“
Damit ist nun ein wichtiger Schritt getan, die Lab-on-a-Chip-Technologie zum industriellen Standard in vielen Bereichen der medizinischen Forschung zu machen.
Großer Erfolg mit Lebergewebe
„Mit diesem Ansatz konnten wir ein Lebermodell mit Blutgefäßen ausstatten. In Zusammenarbeit mit der Keio-Universität (Japan) haben wir ein Leberläppchen auf einem Chip entwickelt, das ein kontrolliertes 3D-Gefäßnetzwerk enthält, das die Anordnung der Zentralvene und Sinusoide in vivo genau nachahmt“, sagt Aleksandr Ovsianikov.
"Die Nachbildung der dichten und komplexen Mikrogefäße der Leber war lange Zeit eine Herausforderung in der Organ-on-Chip-Forschung. Durch den Aufbau mehrerer Schichten von Mikrogefäßen, die das gesamte Gewebevolumen durchziehen, konnten wir eine ausreichende Nährstoff- und Sauerstoffversorgung sicherstellen – was wiederum zu einer verbesserten Stoffwechselaktivität im Lebermodell führte. Wir glauben, dass diese Fortschritte uns einen Schritt näher an die Integration der Organ-on-a-Chip-Technologie in die präklinische Arzneimittelforschung bringen", sagt Masafumi Watanabe (Keio-Universität).
"Die Organ-on-a-Chip-Technologie und fortschrittliche Lasertechnologie lassen sich gut kombinieren, um zuverlässigere Modelle von Blutgefäßen und Lebergewebe zu erstellen. Ein wichtiger Durchbruch ist die Möglichkeit, winzige Gewebe auf einem Chip zu bauen, durch die Flüssigkeit fließen kann, ähnlich wie Blut im Körper. Dies hilft Forschern, besser zu verstehen, wie der Blutfluss die Zellen beeinflusst. Die Organ-on-a-Chip-Technologie ermöglicht es auch, die Reaktionen der Zellen unter dem Mikroskop genau zu beobachten. Diese Modelle werden Wissenschaftlern helfen, die Funktionsweise des Körpers zu untersuchen, und könnten in Zukunft zu besseren Behandlungen und einer besseren Gesundheitsversorgung führen." sagt Prof. Ryo Sudo, Keio-Universität.
TU Wien
Originalpublikation:
A. Salvadori et al., Controlled microvasculature for organ-on-a-chip applications produced by high-definition laser patterning, Biofabrication (2025), DOI:10.1088/1758-5090/add37e