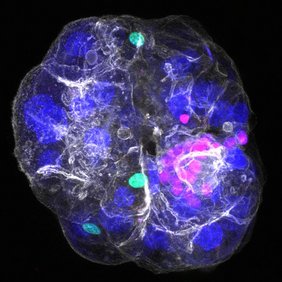
Die Leber hat eine einzigartige Struktur, vor allem im Bereich einzelner Zellen. Hepatozyten, die Hauptzellen der Leber, schütten Galle in winzige Kanäle, die Gallengänge genannt werden, aus, die in den Gallengang im periportalen Bereich der Leber münden. Ist dieses Gallenabflusssystem gestört, kommt es zu Leberschäden und Erkrankungen. Diese einzigartige Architektur hat die Erforschung von Lebererkrankungen bisher eingeschränkt, da es schwierig ist, die komplexe Struktur der Leber und die Zellinteraktionen in einer Petrischale ausserhalb des Körpers nachzubilden. Die bisherigen aus Gewebe gewonnenen Leberorganoidmodelle bestehen nur aus einem Zelltyp und können die komplexe Zellzusammensetzung und Gewebearchitektur, wie beispielsweise die periportale Region der Leber, nicht nachbilden.
Die Forschungsgruppe von Meritxell Huch, Direktorin am Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden, befasste sich bereits 2021 in einer Studie mit dieser Frage (Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation, Cordero-Espinoza, Lucía et al., Cell Stem Cell, Band 28, Ausgabe 11). Dort entwickelten die Forschenden ein Leberorganoid, das aus zwei Zelltypen bestand, Cholangiozyten und Mesenchymzellen. Mit diesem Organoid konnten sie zwar Zell-Zell-Interaktionen und die Anordnung der Zellen modellieren, es fehlten jedoch andere periportale Zelltypen – vor allem Hepatozyten, die den größten Teil der Lebermasse ausmachen.
Entwicklung eines Organoidmodells der nächsten Generation
In der aktuellen Studie, die in der Fachzeitschrift Nature veröffentlicht wurde, konnten Forschende aus der Gruppe von Meritxell Huch zusammen mit Kolleginnen und Kollegen aus den Gruppen von Marino Zerial und Heather Harrington, beide ebenfalls Direktoren am MPI-CBG, ein Organoidmodell der nächsten Generation entwickeln. Dieses „periportales Assembloid“ besteht aus adulten Cholangiozyten und mesenchymalen Leberzellen (wie im vorherigen Modell), enthält nun aber zusätzlich auch Hepatozyten, die wichtigsten funktionellen Zellen der adulten Leber. Dieses Modell kombiniert in einem schrittweisen Prozess verschiedene Zellen, deren Zusammenbau man mit LEGO vergleichen könnte.
„Unser Assembloid rekonstruiert die periportale Region der Leber und kann Aspekte der cholestatischen Leberschädigung und der biliären Fibrose modellieren. Wir haben uns bewusst für diesen Bereich entschieden, da dieser eine wichtige Rolle beim Gallentransport spielt und bei Lebererkrankungen häufig beeinträchtigt ist, da die Verbindung der für den Gallentransport verantwortlichen Zellen blockiert ist,“ erklärt Anna Dowbaj, eine der Erstautorinnen, Postdoktorandin in der Huch-Gruppe und ab Juni 2025 Assistenzprofessorin an der Technischen Universität München (TUM).
„Um unser Ziel zu erreichen, haben wir zunächst Organoide hergestellt, die ausschließlich aus Hepatozyten bestehen, funktionierende Gallengänge bilden und wichtige Eigenschaften echter Hepatozyten im Gewebe beibehalten. Anschließend haben wir Cholangiozyten und Fibroblasten hinzugefügt, um periportale Assembloide herzustellen. Unser Lebermodell funktioniert wie echtes Lebergewebe und transportiert die Galle aus dem Inneren der Leberzellen in die Gallengänge. Das zeigt uns, dass wir die Interaktionen zwischen den verschiedenen Leberzellen nachbilden konnten,“ erklärt Aleksandra Sljukic, ebenfalls Erstautorin der Studie und Doktorandin in der Huch-Gruppe.
Indem die Forschenden die Anzahl mesenchymaler Zellen veränderten, konnten sie eine Reaktion auslösen, die der Leberfibrose ähnelt. Damit konnten sie auch zeigen, dass dieses Modell dazu genutzt werden kann, die Rolle bestimmter Gene bei Lebererkrankungen zu untersuchen, indem normale und mutierte Zellen gemischt oder Gene ausgeschaltet werden.
Mithilfe topologischer Datenanalyse konnten Heather Harrington und ihre Kollegen an der Universität Oxford die Formen der Assembloide klassifizieren. Dabei stellten sie fest, dass einige Formen im Laufe der Zeit mit einer besseren Leberfunktion in Zusammenhang standen.
Untersuchung von Lebererkrankungen und eine Vision für die Zukunft
Meritxell Huch, die die Studie leitete, fasst zusammen: „Wir freuen uns sehr, dass es uns gelungen ist, ein periportales Assembloid-Modell zu entwickeln, das erstmals portales Mesenchym, Cholangiozyten und Hepatozyten kombiniert. Obwohl noch einige Zellen fehlen, darunter Endothel- und Immunzellen, bildet das Modell die zelluläre und strukturelle Architektur des periportalen Bereichs der Leber im Maßstab einer Zellkulturplatte mit hoher Präzision nach. Dank seiner modularen Bauweise lässt es sich außerdem leicht untersuchen, handhaben und im Labor verändern. Unsere Leber-Assembloide sind das erste All-in-One-Labormodell, mit dem der Gallenfluss, Verletzungen der Gallengänge und die Rolle verschiedener Leberzellen bei der Entstehung von Krankheiten untersucht werden können.”
Meritxell Huch fährt fort: „Wir können uns vorstellen, dass unsere periportalen Lebermodelle letztendlich zur Untersuchung von Krankheitsmechanismen eingesetzt werden könnten. Nach der Übertragung auf menschliche Zellen könnte dies ein Weg sein, um von 2D-Modellen, die in pharmazeutischen Screenings verwendet werden, zu physiologischeren 3D-Modellen überzugehen. Mit diesen kann die Wirksamkeit und Toxizität von Medikamenten in einem physiologisch relevanteren Kontext untersucht werden.“
Max-Planck-Institut für molekulare Zellbiologie und Genetik
Originalpublikation:
Dowbaj, A.M., Sljukic, A., Niksic, A. et al. Mouse liver assembloids model periportal architecture and biliary fibrosis. Nature (2025). doi.org/10.1038/s41586-025-09183-9