In einer neuen Studie, veröffentlicht in Cell Reports, zeigen Forschende der Universität Freiburg, wie ein ungeordneter Proteinabschnitt zwei zentrale Schritte der Genexpression miteinander verknüpft: das Ablesen von Genen und die Bearbeitung ihrer RNA-Produkte. Bei dem untersuchten Protein handelt es sich um TAF2, einen Bestandteil des allgemeinen Transkriptionsfaktors TFIID. Eine spezielle, sogenannte intrinsisch ungeordnete Region (IDR) innerhalb von TAF2 wirkt dabei wie ein internes Positionssignal, das das Protein gezielt in bestimmte Bereiche des Zellkerns leitet. Die Studie verdeutlicht, dass flexible Proteinregionen wie die IDR von TAF2 nicht nur die räumliche Organisation molekularer Prozesse prägen, sondern auch durch gezielte Lenkung in nukleäre Speckles als wichtige Regulatoren spezifischer Funktionen wirken könnten — ein Mechanismus, der möglicherweise auch bei krankheitsrelevanten Prozessen von Bedeutung ist.
Die Studie wurde geleitet von Dr. Tanja Bhuiyan, Postdoktorandin am Institut für Experimentelle und Klinische Pharmakologie und Toxikologie der Universität Freiburg sowie am Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies. Die Ergebnisse verdeutlichen die regulatorische Funktion einer Art von Proteindomänen, die in vielen nukleären Proteinen vorkommen, bislang aber kaum erforscht sind.
Ein flexibles Signal, das molekulare Prozesse koordiniert
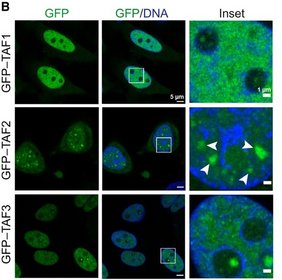
Die intrinsisch ungeordnete Region (IDR) von TAF2 steuert das Protein weg von aktiven Genpromotoren, wo es an der Initiierung der Transkription beteiligt ist, hin zu nukleären Speckles – flüssigkeitsähnlichen Kompartimenten, die wichtige Faktoren für die RNA-Verarbeitung bündeln. Mithilfe einer Kombination aus hochauflösenden Bildgebungsverfahren, genomweiten Sequenzierungsanalysen und Proteomik zeigt das Team, dass TAF2 dynamisch zwischen unterschiedlichen Bereichen im Zellkern wechselt und dabei je nach Aufenthaltsort verschiedene Funktionen übernimmt.
„Wir haben herausgefunden, dass TAF2 nicht nur als Teil des klassischen TFIID-Komplexes an Genpromotoren wirkt“, erklärt Bhuiyan. „Vielmehr ermöglicht diese flexible Region, dass das Protein zwischen verschiedenen nukleären Kompartimenten pendelt – wodurch es mit RNA-verarbeitenden Proteinkomplexen interagieren und die finale Ausgestaltung genetischer Informationen beeinflussen kann.“
Die Forschenden konnten zeigen, dass TAF2 in drei funktionellen Pools vorkommt: im kanonischen TFIID-Komplex an Promotoren, in nicht-kanonischen Komplexen mit dem Spleißfaktor SRRM2 und konzentriert in nukleären Speckles. Nach Entfernen der IDR wanderte TAF2 nicht mehr in die Speckles, sondern sammelte sich vermehrt an Genpromotoren an. Überraschenderweise führte diese Verlagerung nicht zu einer generellen Veränderung der Genaktivität, veränderte jedoch die Art und Weise, wie bestimmte RNA-Transkripte verarbeitet wurden – ein Mechanismus, der als alternatives Spleißen bezeichnet wird. Dadurch können Zellen verschiedene Proteine aus demselben Gen erzeugen.
Von der Struktur zur Funktion: Transkription und RNA-Bearbeitung verbinden
„Diese Ergebnisse deuten darauf hin, dass die räumliche Umlenkung von TAF2 die Aktivierung oder Deaktivierung von Genen nicht direkt steuert“, erläutert Prof. Dr. Sebastian Arnold, Letztautor der Studie und Gruppenleiter am Institut für Experimentelle und Klinische Pharmakologie und Toxikologie der Universität Freiburg sowie am CIBSS. „Stattdessen beeinflusst TAF2, wie Informationen auf der RNA-Ebene verarbeitet werden – eine subtilere, aber potenziell weitreichende Form der Genregulation.“
Die Studie leistet einen wichtigen Beitrag zum Verständnis der räumlichen Organisation molekularer Prozesse. Anstatt ausschließlich linearen Signalwegen zu folgen, nutzen viele Regulationsmechanismen dynamische räumliche Kompartimentierung und flexible Proteinstrukturen. Die Forschung hebt zudem die wachsende Bedeutung intrinsisch ungeordneter Proteinregionen (IDRs) hervor. Einst als strukturell unbestimmt angesehen, werden diese flexiblen Sequenzen heute als Schlüsselelemente in der Bildung biomolekularer Kondensate und als wichtige Regulatoren spezifischer Funktionen erkannt. Die IDR von TAF2 enthält einen konservierten Abschnitt aus Histidin- und Lysinresten und unterstützt damit die Hypothese, dass die gezielte Lenkung in nukleäre Speckles durch Phasentrennung ein grundlegendes Prinzip in der nukleären Genregulation sein könnte.
Zwar thematisiert die aktuelle Studie keine krankheitsrelevanten Mechanismen, jedoch beeinflussten die beobachteten Spleißereignisse Gene, die an Neuroentwicklung und Membrantransport beteiligt sind. Die Ergebnisse lassen vermuten, dass die räumliche Dynamik von TAF2 eine weitreichendere biologische Relevanz haben könnte. Zukünftige Forschungsarbeiten könnten klären, ob dieser Regulationsmechanismus auch bei der Zellidentität, in Stressreaktionen oder bei pathologischen Prozessen eine Rolle spielt.
Universität Freiburg
Originalpublikation:
Bhuiyan T, Arecco N, Mendoza Sanchez PK, Kim J, Schwan C, Weyrauch S, Nizamuddin S, Prunotto A, Tekman M, Biniossek ML, Knapp B, Koidl S, Drepper F, Huesgen PF, Grosse R, Hugel T, Arnold SJ. TAF2 condensation in nuclear speckles links basal transcription factor TFIID to RNA splicing factors. Cell Rep. 2025 Apr 26;44(5):115616.DOI: 10.1016/j.celrep.2025.115616