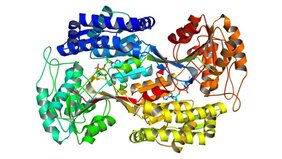
Ein Forscherteam unter der Leitung von Prof. Tobias Erb vom Max-Planck-Institut in Marburg hat festgestellt, dass ein wohlbekanntes Enzym überraschend flexibel ist. Nach experimenteller Evolution im Labor war die Succinat-Semialdehyd-Dehydrogenase (SAD) neben der etablierten Rolle als Entgifter in der Lage, in zwei metabolisch unterschiedlichen Prozessen – der Vitaminentstehung und dem Abbau von Zucker – zu arbeiten. Die Ergebnisse zeigen, wie flexibel „promiskuitive“ Enzyme sind. Sie verdeutlichen zudem das verborgene Potenzial biologischer Systeme für Anwendungen in der synthetischen Biologie.
Während Enzyme in der Regel für ihre Spezifität bekannt sind, können viele durchaus mit unterschiedlichen Substraten arbeiten. Diese promiskuitiven Eigenschaften könnten bei der natürlichen Evolution von Enzymen eine entscheidende Rolle spielen. Allerdings sind sie unter physiologischen Bedingungen oft nur sehr schwach ausgeprägt und bleiben daher oft unerkannt. Um sie nutzbar zu machen, setzen Forscher auf ALE, adaptive Labor-Evolution, bei der verschiedene Mutationen im Genom ausgelöst werden. Die meisten ALE-Studien konzentrieren sich darauf, wie man mit mehreren Enzymen einen einzelnen metabolischen Mangel ausgleichen kann; die Frage, ob ein einzelnes Enzym für verschiedene Stoffwechseldefizite kompensieren kann, wurde bisher nicht untersucht.
Prof. Tobias Erb und sein Team am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg wollen verstehen, wie biochemische Zyklen funktionieren, und dieses Wissen nutzen, um völlig neue Stoffwechselwege zu schaffen. Die Promiskuität von Enzymen ist für sie ein wertvoller Ausgangspunkt, um Reaktionen und Stoffwechselwege zu schaffen, die in der Natur nicht vorkommen.
Labor-Evolution verstärkt Nebenaktivitäten der Enzyme
Die Forschung des Teams konzentrierte sich auf Succinat-Semialdehyd-Dehydrogenase (SAD) in E. coli. Das SAD Enzym ist für seine Rolle in der Entgiftung von Stoffwechsel-Nebenprodukten, giftigen Aldehyden, bekannt. Zur Überraschung der Forschenden konnte SAD, nachdem es der Labor-Evolution unterzogen wurde, den Verlust von Enzymen in zwei weiteren, voneinander unabhängigen Stoffwechselprozessen kompensieren: der Vitamin B6-Biosynthese und der Glykolyse. Diese verborgenen Aktivitäten waren durch die Labor-Evolution verstärkt und damit sichtbar geworden.
„Wir haben nicht gezielt versucht, diese Defizite zu überbrücken; es war eher ein zufällig entdeckter Effekt. Aber als wir die Ergebnisse der gerichteten Evolution sahen, waren wir erstaunt über die Plastizität des aktiven Zentrums von SAD, die dem Enzym ermöglicht, in solch unterschiedlichen Stoffwechselprozessen zu funktionieren“, sagt Dr. Hai He, Erstautor der in Nature Communications veröffentlichten Studie.
Aufbauend auf ihrer Entdeckung setzten die Forscher in weiteren Untersuchungen eine Vielzahl von Techniken ein. Sie verwendeten eine Kombination aus ALE, biochemischer Analyse, struktureller Untersuchung und sogenannten Omics-Ansätzen – einschließlich Gesamtgenomsequenzierung, Metabolomik und Proteomik –, um die evolutionären Schritte aufzuklären, die zu den neuen Fähigkeiten von SAD führten.
Die Promiskuität von Enzymen ist eine wertvolle Ressource für zukünftige Innovationen
Die Forscher fanden heraus, dass ALE die verborgenen Fähigkeiten des Enzyms auf verschiedene Weise herausgebracht hatte: durch die Erhöhung verschiedener Mutationen in seinem aktiven Zentrum, was seine Aktivität steigerte; durch die Veränderung direkter und indirekter regulatorischer Elemente, was die Menge des SAD-Proteins steigerte; und durch die Vergrößerung der Genkopienzahl, was die SAD-Spiegel weiter erhöhte.
Die Studie deckt nicht nur regulatorische Zusammenhänge im Stoffwechsel auf, sondern hebt auch das Potenzial der Enzymflexibilität als treibende Kraft in der Stoffwechselentwicklung und als wertvolle Ressource für biotechnologische Innovationen hervor. „Zu verstehen, wie diese Mechanismen auf Stoffwechsel- und Regulationsebene miteinander verflochten sind, ist eine komplexe Herausforderung“, sagt Tobias Erb. “Hier ist, insbesondere im Hinblick auf neue Synthesewege, die nachhaltigere oder neue Produkte bieten, eine systematische Erforschung der verborgenen Stoffwechselwege notwendig, um künftige Innovationen in der Enzymtechnik anzustoßen.“
Max-Planck-Institut für terrestrische Mikrobiologie
Originalpublikation:
He, H., Gómez-Coronado, P.A., Zarzycki, J. et al. Adaptive laboratory evolution recruits the promiscuity of succinate semialdehyde dehydrogenase to repair different metabolic deficiencies. Nat Commun15, 8898 (2024). doi.org/10.1038/s41467-024-53156-x