Das Vererbungsmolekül DNA, Trägerin der Erbinformation eines Organismus, besteht aus vier Bausteinen, abgekürzt A, C, G und T. Die Kombination dieser vier Moleküle reicht aus, um die Baupläne sämtlicher Proteine unseres Körpers weiterzugeben. „Die DNA dient aber auch dazu, die Produktion der Proteine genau zu regulieren“, erklärt Leitautor Dr. Robert Liefke vom Institut für Molekularbiologie und Tumorforschung der Philipps-Universität Marburg. Häufen sich an einer Stelle der DNA die Bausteine C und G, so spricht die Fachwelt von einer CG-Insel. „Diese Abschnitte bilden Schlüsselstellen für die Steuerung von Genen“, legt der Biochemiker dar. „Aber wie sie dazu beitragen, Gene an- oder abzuschalten, war bislang wenig fassbar.“
Liefke und sein Team forschten systematisch nach Proteinen, die an CG-Inseln andocken; hierfür durchsuchten sie insbesondere Datenbanken und einschlägige Veröffentlichungen. „In den vergangenen Jahren ist die Menge an verfügbarer Literatur, an Daten und computergestützten Werkzeugen exponentiell gestiegen“, berichtet Liefkes Mitarbeiter Dr. Bastian Stielow, ein weiterer Leitautor der Fachpublikation.
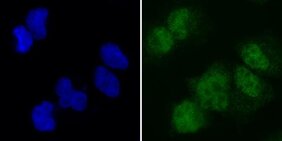
Die Forschungsgruppe nutzte die öffentlich verfügbaren Informationen und stieß dabei auf das Protein SAMD1. Gemeinsam mit internationalen Kolleginnen und Kollegen fand das Team heraus, dass SAMD1 an CG-Inseln andockt, die in einer bestimmten chemischen Form vorliegen. Erstaunlicherweise war das Protein bislang kaum erforscht.
Wie die weiteren Untersuchungen ergaben, wirkt SAMD1 mit anderen Proteinen zusammen, um die Verpackung der DNA an denjenigen Stellen chemisch zu verändern, an denen sich CG-Inseln befinden. Die Verpackung trägt zur korrekten Umsetzung der Gene in Proteine bei. „Unsere Ergebnisse etablieren SAMD1 als einen neuen Faktor, der die Verpackung der DNA dort steuert, wo sich CG-Inseln befinden“, fasst Liefke zusammen.
Welche Bedeutung dem Protein SAMD1 zukommt, zeigt sich an embryonalen Stammzellen. Fehlt SAMD1, so kommt es zu Fehlern bei der Reifung der Stammzellen, fand das Team in Zellkulturexperimenten heraus.
Warum aber stieß die Wissenschaft nicht schon früher auf SAMD1, warum gerät das Molekül erst jetzt in den Fokus der Forschung? Liefke und Stielow stellten fest, dass sowohl Datenbanken als auch die wissenschaftliche Literatur falsche oder unvollständige Informationen über das Protein enthalten.
So scheint es bisweilen zu einer Verwechslung mit einem anderen Protein gekommen zu sein: Dieses ist wissenschaftlich sehr gut untersucht und trägt die ganz ähnliche Kurzbezeichnung SMAD1. „Es lohnt sich, Suchmaschinen und rechnerbasierte Werkzeuge zu nutzen, um die verfügbare Literatur und Datenbanken kritisch zu durchforsten und bislang übersehene Moleküle zu entdecken“, resümiert Liefke.
Die Lebenswissenschaften gehören zu den Forschungsschwerpunkten der Philipps-Universität Marburg. Der Biochemiker Robert Liefke leitet eine Nachwuchsgruppe am Institut für Molekularbiologie und Tumorforschung der Universität. Neben seinem Team sowie weiteren Wissenschaftlerinnen und Wissenschaftlern der Philipps-Universität beteiligten sich Forscherinnen und Forscher aus Köln, Boston in den USA und Peking in China an der Veröffentlichung. Die Deutsche Forschungsgemeinschaft, die Fritz-Thyssen-Stiftung, die American Cancer Society sowie die Nationale Stiftung Chinas für Naturwissenschaften unterstützten beteiligte Forscherinnen und Forscher finanziell.
Universität Marburg
Originalveröffentlichungen:
Bastian Stielow, Yuqiao Zhou, Yinghua Cao & al.: The SAM domain-containing protein 1 (SAMD1) acts as a repressive chromatin regulator at unmethylated CpG islands, Science Advances 2021, DOI: 10.1126/sciadv.abf2229
https://doi.org/10.1126/sciadv.abf2229
Bastian Stielow, Clara Simon & Robert Liefke: Making fundamental scientific discoveries by combining information from literature, databases, and computational tools – an example, Computational and Structural Biotechnology Journal 2021