Eine grundsätzliche Frage in der Neuro- und Entwicklungsbiologie besteht darin, wie vielzellige Organismen in ihrer individuellen Entwicklung unterschiedlich organisierte Nervensysteme ausbilden, die ihnen ein arttypisches Verhaltensrepertoire ermöglichen. Die hohe neuronale Komplexität vieler Lebewesen erschwert jedoch die Untersuchung der dabei ablaufenden Mechanismen. Ein Forschungsteam um Thomas Bosch, Professor für Zell- und Entwicklungsbiologie an der Christian-Albrechts-Universität zu Kiel (CAU), hat nun am Beispiel des Süßwasserpolypen Hydra, einem etablierten Modellorganismus für die Neurobiologie und Mikrobiomforschung, neue Erkenntnisse über die bestimmenden Faktoren des Zustandekommens des Nervensystems während der Embryonalentwicklung der Tiere gesammelt.
Dank eines interdisziplinären Forschungsansatzes aus innovativen Bildgebungsverfahren für die Ca²⁺ Aktivität von Nervenzellen und bioinformatischen Analysen konnte das Kieler Team, das am CAU-Sonderforschungsbereich (SFB) 1182 „Entstehen und Funktionieren von Metaorganismen“ sowie dem SFB 1461 „Neurotronics“ beteiligt ist, die Entwicklung von der Aktivierung einzelner Neuronen bis hin zu einem funktionierenden Nervennetz im Detail nachverfolgen. Bisherige Theorien gingen davon aus, dass stammesgeschichtlich alte neuronale Schaltkreise ein Netzwerk aus zufällig verbundenen Nervenzellen sind. Die Kieler Wissenschaftlerinnen und Wissenschaftler konnten nun unter anderem in Zusammenarbeit mit Kolleginnen und Kollegen der Ruhr-Universität Bochum zeigen, dass sich das Nervennetz durch die Aktivität einzelner Neuronen und ihre dadurch entstehende Vernetzung untereinander selbständig organisiert. Die erwachsenen Tiere erlangen so letztlich ihr breites Verhaltensspektrum, das neben der Nahrungsaufnahme unter anderem ihre Kontraktionsmuster und verschiedene Fortbewegungsarten umfasst.
Zusätzlich fanden die Kieler Forschenden heraus, dass diese Entwicklung anders als bisher angenommen nicht rein genetisch festgelegt ist, sondern durchaus plastisch ist und durch Umweltfaktoren wie die Temperatur oder die An- oder Abwesenheit der natürlichen Mikrobenbesiedlung der Polypen beeinflusst werden kann. Dank dieser Plastizität erscheint es möglich, dass sich vielzellige Organismen mit ihrem Nervensystem rasch an geänderte Umweltbedingungen anpassen können. Das Forschungsteam schlägt daher vor, dass das Prinzip der Selbstorganisation und Plastizität universell für die neuronale Entwicklung vielzelliger Lebewesen gelten könnte. Die neuen Ergebnisse aus dem SFB 1182 sind kürzlich in der renommierten Fachzeitschrift Proceedings of the National Academy of Sciences of the United States of America (PNAS) erschienen.
Nervenzellen organisieren sich selbst über ihre beginnende Aktivität
Um die bislang wenig erforschten initialen Prozesse bei der Entstehung des Nervensystems in einem Individuum beobachten zu können, haben die Kieler Wissenschaftlerinnen und Wissenschaftler Hydren in einem späten Stadium der Embryonalentwicklung untersucht. Die erwachsenen Tiere verfügen über ein sogenanntes diffuses Nervensystem mit rund 3000 bis 5000 einzelnen Nervenzellen, die in insgesamt sieben Nervenpopulationen zur Steuerung des Verhaltens unterteilt sind. Das Forschungsteam wählte eine einzelne Gruppe, die N4-Population aus, von der aus früheren Forschungsarbeiten eine zentrale Beteiligung am Fressverhalten der Tiere bekannt war und untersuchte die Entwicklung der daran beteiligten Neuronen.
„Wir haben die Embryonen über einen Zeitraum von siebeneinhalb Stunden beobachtet und im Laufe dieser Zeit sechs jeweils 30-minütige Aufnahmen per sogenanntem Kalzium-Imaging gemacht, anhand derer wir die Aktivität aller individuellen Nervenzellen nachvollziehen konnten“, erklärt Christopher Noack, Wissenschaftler in der Arbeitsgruppe Zell- und Entwicklungsbiologie am Zoologischen Institut. „Dabei zeigte sich, dass zunächst nur einzelne Neuronen anfangen, Impulse auszusenden. Über die Zeit bilden sich daraus kleine Cluster aus wenigen Zellen, die sich verbinden und dabei ein synchrones Signal aussenden“, so SFB 1461-Mitglied Noack weiter.
Auf diese Weise bildet sich Stück für Stück eine dominante Gemeinschaft von Nervenzellen aus, die über ihre zunehmende Aktivität zusätzliche Cluster von Nervenzellen integriert und so weiter an Größe zunimmt. Insgesamt formt sich damit vom künftigen Mundbereich der Embryonen ausgehend bis hinab in den übrigen Körper das vollständige Nervennetz der Tiere. „Bislang ging man davon aus, dass sich die Nervenzellen zunächst im Körper positionieren und dann aktiv werden. Stattdessen fangen sie jedoch dezentral in bestimmten Körperregionen wie dem Mundbereich an, sich auszudifferenzieren und aktiv zu werden. Der Prozess der Vernetzung und Synchronisierung läuft dabei offenbar autonom und selbstorganisiert ab“, so Noack weiter.
Umwelteinflüsse prägen die Ausbildung des Nervensystems
Um herauszufinden, ob der Aufbau des Nervennetzes bei Hydra ein rein genetisch festgelegter Prozess oder zusätzlich von Umwelteinflüssen abhängig ist, haben die Kieler Forschenden anschließend den Einfluss des Mikrobioms und der Temperatur untersucht. Zunächst überprüften sie den Einfluss der Temperatur. „Wir haben festgestellt, dass niedrige Temperaturen vorteilhaft sind und dazu führen, dass sich das Nervennetz besser zusammenfügt und dieser Prozess insgesamt schneller abläuft“, erklärt Noack. Warme Temperaturen dagegen haben einen eher negativen Effekt auf die Ausbildung des Nervensystems. „Bei einer Temperaturerhöhung von 18 auf 23 Grad Celsius zeigte sich, dass sich nur kleinere Neuronengruppen bildeten. Zudem konnte sich die typische dominante Community nicht etablieren, stattdessen bildeten sich viele kleine, schlechter verbundene Neuronencluster“, erklärt Noack. Diese Einschränkungen führten dazu, dass die Funktion des am Fressverhalten beteiligten Nervennetzes gestört war: Etwa 40 Prozent dieser Tiere konnte bei erhöhter Temperatur keine Nahrung mehr aufnehmen.
In einem nächsten Schritt überprüften die Forschenden, ob auch das Mikrobiom auf die neuronale Entwicklung einwirken kann: Dazu haben sie Hydra-Embryonen von den besiedelnden Bakterien befreit und die neuronale Entwicklung in solchen keimfrei gemachten Embryonen dann mit Kontrollen verglichen, die von Mikroben besiedelt waren. „Anders als der Wildtyp zeigen keimfreie Hydra-Embryonen insgesamt eine deutlich reduzierte Anzahl an Neuronen. Diese Beobachtung weist also auf eine Beteiligung des Mikrobioms an der Entwicklung des Nervensystems hin“, betont Noack.
Interessanterweise haben Embryonen, die sich ohne Mikroben entwickeln, nicht nur eine geringere Anzahl von Nervenzellen, sondern auch eine signifikant geringere Zahl von neuronalen Fortsätzen, die zur Verknüpfung mit anderen Neuronen benötigt werden. Kolonisiert man solche keimfreien Embryonen nachträglich mit Mikroben, wird dieser Defekt wett gemacht und die zwar immer noch vergleichsweise wenigen Neuronen bilden nun eine relativ große Zahl an Fortsätzen. „Wir vermuten, dass die Wiederherstellung des Mikrobioms die Beeinträchtigung des Nervensystems durch eine bessere Vernetzung der vorhandenen Zellen in Teilen kompensiert, was ihre geringere Anzahl offenbar ausgleichen und ihre Funktionen wahren kann“, vermutet Bosch, der den CAU-Forschungsschwerpunkt Kiel Life Science (KLS) leitet.
Diese Beobachtungen, so die Forschenden, ließen sich auch anhand anderer keimfreier Modellorganismen bestätigen, etwa bei Fruchtfliegen, Zebrafischen und auch Mäusen. Noch ist unklar, wie Temperatur und Mikrobiom die Anzahl und Verknüpfung von Nervenzellen beeinflussen. Die Erkenntnis, dass stammesgeschichtlich alte neuronale Schaltkreise nicht als zufällig verbundene Netzwerke beginnen, sondern sich durch Selbstorganisation in einem dynamischen Prozess bilden und wachsen, bei dem Stabilität und Präzision durch Mechanismen erreicht werden, die ein erhebliches Maß an struktureller und funktioneller Plastizität beinhalten, ist nicht nur von evolutions- und neurobiologischem Interesse, sondern auch relevant für das Verständnis und den Entwurf neuartiger künstlicher neuronaler Netzwerke.
„Insgesamt zeigt unsere neue Arbeit, dass die Entwicklung des Nervensystems von Umweltbedingungen im Allgemeinen beeinflusst werden kann und seine Entwicklungsprozesse über einen hohen Grad an Anpassungsfähigkeit oder Plastizität verfügen. Insbesondere das Mikrobiom scheint dabei eine wichtige Rolle zu spielen. Dies unterstreicht erneut die fundamentale Bedeutung der natürlichen Mikrobenbesiedlung für die Entwicklung und Funktion von vielzelligen Lebewesen“, fasst Bosch zusammen.
Fotos stehen zum Download bereit:
https://www.uni-kiel.de/de/pressemitteilungen/2025/097-noack-pnas-authors.JPG
Bildunterschrift: Das Kieler Forschungsteam, im Bild Prof. Thomas Bosch, Christopher Noack und Jörg Wittlieb (v.r.n.l.), fand heraus, dass sich das Nervennetz der Hydra während der Embryonalentwicklung aktivitätsabhängig organisiert und dabei von Umweltfaktoren wie Temperatur und Mikrobiom beeinflusst wird.
© Christian Urban, Uni Kiel
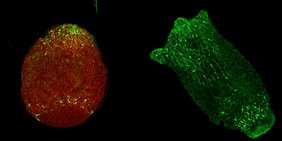
https://www.uni-kiel.de/de/pressemitteilungen/2025/097-noack-pnas-neurons.jpg
Bildunterschrift: In verschiedenen Stadien der Entwicklung zeigt sich, dass bestimmte Nervenzellpopulationen und ihre Verbindungen nur im künftigen Kopf- und Fußbereich der Hydra zu finden sind (Neuronen grün eingefärbt, links zusätzlich in rot: Aktinfilamente, die das Cytoskelett der Zellen bilden).
© Christopher Noack
https://www.uni-kiel.de/de/pressemitteilungen/2025/097-noack-pnas-screen.JPG
Bildunterschrift: Die Forschenden vermuten, dass bereits evolutionär frühe Nervensysteme die Fähigkeit zur Anpassung an sich rasch ändernde Umweltbedingung haben und das Prinzip der Selbstorganisation und Plastizität universell für die neuronale Entwicklung vielzelliger Lebewesen gelten könnte.
© Christian Urban, Uni Kiel
(Christian-Albrechts-Universität zu Kiel)
Originalpublikation:
Christopher Noack, Sebastian Jenderny, Christoph Giez, Ornina Merza, Lisa-Marie Hofacker, Jörg Wittlieb, Urska Repnik, Marc Bramkamp, Karlheinz Ochs, Thomas C. G. Bosch (2025): Assembly of a functional neuronal circuit in embryos of an ancestral metazoan is influenced by temperature and the microbiome. PNAS First published: 5. June 2025
https://doi.org/10.1073/pnas.2501225122