Wie bewegen sich Zellen von A nach B durch unseren Körper, um zu ihrem eigentlichen Zielgewebe zu gelangen? Und wie wird dieser Vorgang reguliert? Die Antworten auf diese Fragen sind essenziell – zum Beispiel für unser Verständnis, wie bei Tieren und Menschen aus einer befruchteten Eizelle ein lebensfähiger Organismus entsteht. Besonders bei der Entwicklung unseres Gehirns, der Bildung von Gefäßen oder der Besiedlung des Knochenmarks durch Stammzellen des Blutes müssen Zellen oft weite Wege im Organismus zurücklegen. Und auch bei schweren Krankheiten spielt die Wanderung von Zellen im Körper eine Rolle – zum Beispiel bei der Streuung bösartiger Tumore.
In ihrer aktuellen Studie in dem Fachjournal BMC Biology ist es Forschenden der Universität Konstanz um den Biologen Christof Hauck nun gelungen, ein bei allen Säugetieren vorhandenes Enzym zu identifizieren, das für die effiziente Migration von Zellen notwendig ist: die sogenannte Protein-Phosphatase PPM1F. Interessanterweise trägt dieses Enzym neben seiner eigentlichen biologischen Funktion auch dazu bei, dass bösartige Tumorzellen besonders effizient in Gewebe einwandern können. Das Protein könnte also in Zukunft als vielversprechender Ansatzpunkt für die Unterdrückung der Tumormetastasierung dienen.
Für die Embryonalentwicklung unentbehrlich
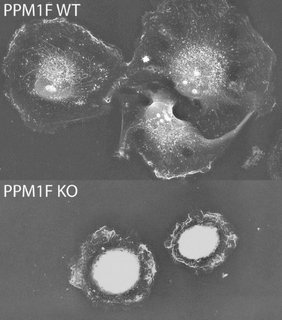
PPM1F wurde bereits zuvor mit der Regulation des Zellskeletts und der Steuerung der Aktivität sogenannter Integrine in Verbindung gebracht – beides wichtige Komponenten der Zellbewegung. In ihrer neuen Studie untersuchten die Konstanzer Forschenden zunächst an Mäusen, welche Auswirkungen der vollständige Verlust dieses Enzyms hat. „Genau wie wir Menschen haben Mäuse in ihrem Erbgut zwei Kopien eines jeden Gens. Ist eine der Kopien für das PPM1F defekt, die andere jedoch intakt, entwickeln sich die Tiere normal und sind auch fortpflanzungsfähig“, erklärt Hauck.
Fehlt die Erbinformation für das PPM1F aufgrund zwei defekter Kopien des Gens dagegen vollständig, kommt es zu schweren Entwicklungsstörungen im entstehenden Gehirn und Gefäßsystem der Embryonen, und deren Entwicklung bricht zu einem frühen Zeitpunkt ab. So bleiben beispielsweise die neugebildeten Nervenzellen dieser Embryonen an ihrem Entstehungsort – dem Ventrikel im zentralen Nervensystem – stecken und können die verschiedenen Schichten der Großhirnrinde nicht aufbauen.
Anhand von Experimenten mit isolierten Zellen fanden die Biologinnen Tanja Grimm, Nina Dierdorf, Marleen Herbinger und Sarah Baumgärtner aus Haucks Team zusätzlich heraus, dass der Verlust von PPM1F zu einer verstärkten Haftung der Zellen führt. Die Zellen sind dadurch in ihrer Fortbewegung stark eingeschränkt und breiten sich kaum auf dem Substrat aus. Zellen ohne PPM1F bleiben dadurch im Vergleich auch kleiner als normale Zellen. Dieser Einfluss von PPM1F auf die Zellhaftung könnte erklären, weshalb die gezielte Zellwanderung bei Mäusen ohne intaktes PPM1F-Gen gestört ist.
Auch Tumorzellen wandern
„Zellmigration ist jedoch nicht nur während der Gewebebildung im Embryo wichtig. Sie spielt beim Menschen zum Beispiel zusätzlich bei Wundheilungsprozessen, aber auch bei der Metastasierung von Tumoren eine Rolle“, so Herbinger. Sie untersuchte die Invasion menschlicher Tumorzellen mit Hilfe von Zellkulturen und konnte zeigen, dass der PPM1F-Spiegel in verschiedenen menschlichen Tumorzelllinien direkt mit dem invasiven Potenzial der Zellen in Zusammenhang steht.
„Auch in komplexeren Gewebemodellen unterbleibt die Tumorzellinvasion, wenn wir in den Zellen das PPM1F-Gen gezielt ausschalten“, so Herbinger. „Wenn wir hingegen die Tumorzellen dazu bringen, mehr PPM1F zu bilden, dann steigt auch ihr Potential zur Gewebeinvasion deutlich an.“ In der Tat finden sich bei einer Reihe menschlicher Tumoren erhöhte Spiegel von PPM1F, sodass sich die in der Zellkultur und die von den Mäusen erhaltenen Erkenntnisse mit großer Wahrscheinlichkeit auch auf die Situation im menschlichen Körper übertragen lassen.
„Unsere Ergebnisse zeigen, dass PPM1F eine wichtige Rolle in der Regulation der Zellmigration spielt – sowohl in der frühen Embryonalentwicklung als auch bei der Invasivität von Tumorzellen“, erklärt Hauck. „Das macht PPM1F zu einem vielversprechenden Ziel für künftige therapeutische Ansätze.“ Die Wissenschaftler*innen hoffen nun, dass ihre grundlegenden Einblicke in die molekularen Zusammenhänge zwischen der Funktion von PPM1F und der Zellmigration einen wichtigen Anstoß liefern, um gezielt nach Wirkstoffen zur Hemmung von PPM1F zu suchen.
Universität Konstanz
Originalpublikation:
Grimm, T.M., Dierdorf, N.I., Herbinger, M. et al. The phosphatase PPM1F, a negative regulator of integrin activity, is essential for embryonic development and controls tumor cell invasion. BMC Biol23, 166 (2025). doi.org/10.1186/s12915-025-02254-3