Während des gesamten Lebens sorgen Blutstammzellen im Knochenmark dafür, dass unser Körper ausreichend mit ausgereiften Blutzellen versorgt wird. Besteht gerade kein aktueller Bedarf an Zell-Nachschub, so verharren die Blutstammzellen in einem tiefen Schlaf um sich vor Schädigungen im Erbgut zu schützen, die zu Krebs führen können. Blutverlust, Infektionen und Entzündungen wirken wie ein Wecker: Unverzüglich beginnen die Blutstammzellen mit der Zellteilung und produzieren Nachschub – etwa, um Immunzellen für die Virenabwehr bereitzustellen oder um einen Verlust an roten Blutkörperchen oder Blutplättchen auszugleichen. Bei jeder Zellteilung regenerieren sich die Stammzellen immer auch selbst, damit der Stammzellpool erhalten bleibt. Dies bezeichnen Wissenschaftler als Selbsterneuerung.
„Der Schlafzustand ist die Voraussetzung für diese einzigartige Fähigkeit der Stammzellen“, erklärt Andreas Trumpp, Stammzellforscher vom DKFZ und HI-STEM. Die fast unbegrenzte Selbsterneuerungsfähigkeit gilt als zentrale Eigenschaft der sehr seltenen Stammzellen, die für Erhaltung und Reparatur von Geweben und Organen eine zentrale Rolle spielen. Krebszellen besitzen diese Fähigkeit jedoch auch. Sie stammen entweder direkt von Stammzellen ab oder erwerben diese Fähigkeit durch genetische Veränderungen. „Ohne Selbsterneuerung kein Krebs“, bringt es Trumpp auf den Punkt.
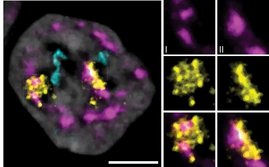
Ein Forscherteam um Andreas Trumpp wollte nun herausfinden, welche molekularen Signale die Selbsterneuerungsfähigkeit steuern. Bei ihren aktuellen Analysen entdeckten sie an Mäusen, dass schlafende Blutstammzellen große Mengen des Rezeptorproteins Neogenin-1 (Neo-1) auf ihrer Oberfläche tragen. Andere Blutzellen dagegen produzieren diesen Rezeptor nicht. Bei weiteren Untersuchungen entpuppte sich Neo-1 als Schlüsselmolekül für die Selbsterneuerung: Schalteten die Forscher den Rezeptor in Mäusen genetisch aus, schliefen die Stammzellen nicht mehr, verloren damit ihre Fähigkeit zur Selbsterneuerung und das blutbildende System der Tiere erschöpfte sich vorzeitig.
Bei Neo-1 handelt es sich um einen Rezeptor, über den die Stammzelle externe Signale empfangen kann. Doch woher kommen diese wichtigen Signale, die für die Selbsterneuerungsfähigkeit essentiell sind? Die Forscher identifizierten das Signalmolekül Netrin-1 als Bindungspartner und Aktivator des Neo-1 Rezeptor. Netrin-1 wird von den Endothelzellen gebildet, die die feinen Blutgefäße im Knochenmark auskleiden. „Wir haben Netrin-1 in der Stammzell-Nische des Knochenmarks der Mäuse genetisch ausgeschaltet. Die Blutstammzellen verloren daraufhin die Selbsterneuerungsfähigkeit. Bei einer experimentellen Steigerung der Netrin-1-Produktion dagegen schliefen sie umso tiefer“, sagt Simon Renders, der Erstautor der Studie.
Die Strukturen in der direkten Nachbarschaft der Stammzellen bezeichnen Wissenschaftler als Stammzell-Nische. Die Nische kann aus zellulären und nicht-zellulären Komponenten bestehen und übt großen Einfluss auf die Funktionen und das Schicksal der Blutstammzellen aus. Auch die Netrin-1-tragenden Zellen der Blutkapillaren sind Bestandteil der Nische. „Unsere Ergebnisse bestätigen erneut die zentrale Rolle der Stammzellnische für die Funktion der Stammzellen und damit für die Regenerationsfähigkeit und die Gesundheit unseres Körpers“, erklärt Trumpp.
Auch die altersbedingte Erschöpfung des blutbildenden Systems ließ sich an den Tieren nachvollziehen: Im Alter verändert das Knochenmark seine Struktur, insbesondere die winzigen Arterien degenerieren. An älteren Mäusen konnten die Wissenschaftler zeigen, dass dies mit einem Verlust von Netrin-1 einhergeht. Die Blutstammzellen versuchen zunächst, diesen Mangel ihres wichtigen Signalgebers durch eine gesteigerte Neo-1-Bildung zu kompensieren. Doch mit steigendendem Lebensalter reicht diese Kompensation nicht mehr aus, das blutbildende System verliert zunehmend seine Selbsterneuerungsfähigkeit. Resultat dieser Veränderungen ist ein im Alter zunehmend schwächeres Immunsystem.
DKFZ
Originalpublikation:
Simon Renders et al.: Niche derived netrin-1 regulates hematopoietic stem cell dormancy via its receptor neogenin-1,
Nature Communications 2021; DOI: https://doi.org/10.1038/s41467-020-20801-0