Die vergangenen Monate haben gezeigt, wie wichtig eine funktionierende Diagnostik von Krankheitserregern ist – und zugleich ein Dilemma offenbart: Antigenschnelltests sind zwar vergleichsweise preiswert, mit geringem Aufwand verbunden und liefern bereits nach wenigen Minuten ein Ergebnis, sie sind jedoch bei weitem nicht so sicher wie ein PCR-Test. Im Gegensatz dazu sind PCR-Tests sehr zuverlässig, aber extrem aufwändig und teuer – und auf das Ergebnis wartet man viele Stunden, zum Teil mehrere Tage. Ein Team aus Forschenden des Uniklinikums Erlangen UKER der FAU und der Universität Würzburg hat ein Verfahren entwickelt, das dieses Dilemma lösen und beide Welten – höchste Sensitivität auf der einen und einfache und schnelle Vor-Ort-Diagnostik auf der anderen Seite – zusammenbringen könnte.
Nanoverbindungen mit spezifischem Fingerabdruck
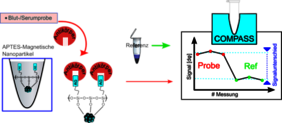
Die Basis dieser Methode sind magnetische Nanopartikel – einige hundert Nanometer große Eisenoxidkugeln, die mit spezifischen Oberflächen versehen werden. „Wir können die Oberflächen dieser Partikel so verändern, dass ganz bestimmte Moleküle aus der Probe andocken“, erklärt Prof. Dr. Christoph Alexiou, Oberarzt an der HNO-Klinik des UKER, Else Kröner-Fresenius-Stiftungsprofessur für Nanomedizin und Leiter der Sektion für Experimentelle Onkologie und Nanomedizin (SEON). Die Verbindung der Nanopartikel etwa mit bestimmten Antikörpern oder -genen führt zu Molekülformen, die ein eindeutiges Bewegungsmuster beispielsweise in rotierenden Magnetfeldern besitzen. PD Dr. Rainer Tietze, stellvertretender Leiter der SEON, vergleicht das mit dem Pirouetten-Effekt beim Eiskunstlauf: „Lassen die Läufer ihre Arme nahe am Körper, dann drehen sie sich schneller, strecken sie ihre Arme zur Seite aus, werden sie langsamer.“
Die eingeschränkte Mobilität der Verbindungen kann mit einem geeigneten Gerät detektiert werden. Hier kommen die Würzburger Kollegen ins Spiel: Ein Forschungsteam um Dr. Patrick Vogel vom Lehrstuhl für Experimentelle Physik V hat ein neuartiges Messverfahren mit den Namen COMPASS entwickelt – die Abkürzung steht für „Critical Offset Magnetic PArticle SpectroScopy“. Dabei werden die Nanopartikel sowohl mit permanenten als auch mit zeitlich veränderten Magnetfeldern angeregt. Da die Kügelchen selbst wie kleine Permanentmagnete funktionieren, kann man sie auf diese Weise zum Schwingen oder Rotieren bringen. Zugleich birgt die Methode einen Verstärkungseffekt, der – ähnlich optischer Interferenzen – bei geringen Modifikationen der Signalquelle zu einer großen Veränderung der Magnetisierungsantwort führt. Rainer Tietze: „Misst man das gesamte Ensemble an funktionalisierten Nanopartikeln in der Probe, erhält man einen spezifischen Fingerabdruck und kann zuverlässige Aussagen über die Konzentration bestimmter Moleküle treffen.“
Alternative zu aufwändigen Diagnoseverfahren
Die Wissenschaftler haben gezeigt, dass mit geringem technischem Aufwand hochempfindliche Messungen in sehr kurzer Zeit durchgeführt werden können. In einem Schnelltest konnten beispielsweise SARS-CoV-2-Antikörper innerhalb weniger Sekunden mit robusten Ergebnissen nachgewiesen werden. Da das Diagnosegerät in einen kleinen Koffer passt und die Materialkosten nur wenige hundert Euro betragen, könnte das COMPASS-Set schon bald zur Standardausrüstung für die Point-of-Care-Diagnose gehören und eine echte Alternative zu aufwändigen und teuren Analyseverfahren wie ELISA oder Durchflusszytometrie werden. Christoph Alexiou fasst den Einsatzbereich jedoch noch deutlich weiter: „Schnelltests im Bereich der humanen Prävention sind nur ein denkbares Feld. Vorstellbar sind darüber hinaus das großflächige Screening von Nutztieren auf meldepflichtige Erkrankungen, aber auch Anwendungen etwa in der Biochemie oder Pharmazie bei der Erforschung von Rezeptorbindungen und Wirkstoffen.“
Die Sektion für Experimentelle Onkologie und Nanomedizin am UKER ist führend im Design funktioneller Nanopartikel, die durch ihre spezielle Beschichtung nicht nur herausragende Eigenschaften erhalten, sondern auch gut reproduzierbar und – im Falle von In-vivo-Anwendungen – ungefährlich sein müssen. „Dieser Erfolg ist ohne Förderung nicht denkbar“, sagt Christoph Alexiou. „Ich möchte hier besonders der Manfred-Roth-Stiftung aus Fürth danken, die uns seit Jahren finanziell unterstützt und Spitzenforschung im Bereich der Nanomedizin möglich macht.“
Friedrich-Alexander-Universität Erlangen-Nürnberg
Originalpublikation:
Vogel, P., Rückert, M.A., Friedrich, B. et al. Critical Offset Magnetic PArticle SpectroScopy for rapid and highly sensitive medical point-of-care diagnostics. Nat Commun13, 7230 (2022). doi.org/10.1038/s41467-022-34941-y