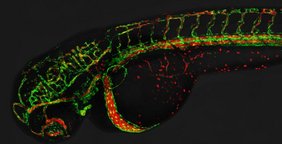
Blutgefäße durchziehen den gesamten Körper und versorgen ihn über das Blut mit Nährstoffen und Sauerstoff. Bei der Gefäßbildung formen Zellen neue Hohlräume, die miteinander fusionieren und schließlich ein Netzwerk von Röhren bilden, durch das Blut strömt. Die Naht zwischen den einzelnen Gefäßzellen muss dabei gut verklebt und stabil sein, damit die Gefäße dicht und robust sind.
Das Team von Prof. Dr. Markus Affolter am Biozentrum der Universität Basel hat nun in zwei Studien die Gefäßbildung im Zebrafisch genauer untersucht. Die Forschenden konnten einerseits zeigen, dass das Protein Rasip1 eine Schlüsselrolle bei der Bildung neuer Gefäßhohlräume übernimmt. Darüber hinaus stellten sie fest, dass Kontraktionskräfte dafür sorgen, dass die Zellen miteinander interagieren. Diese Kräfte sind für die kontinuierliche Bildung von Gefäßhohlräumen notwendig.
Schlüsselrolle von Rasip1 bei der Gefäßbildung
In der ersten Studie, veröffentlicht in «Nature Communications», zeigen die Forschenden, dass das Protein Rasip1 entscheidend an der Entstehung von Blutgefäßen beteiligt ist. Dabei galt ihr Augenmerk vor allem den Kontaktflächen zwischen zwei Zellen, der Verbindungsstelle.
Sie beobachteten, dass sich diese Kontaktflächen in einen Hohlraum verwandeln wie zwei Hälften einer Nussschale, die am Rand miteinander verbunden und verklebt sind. Dabei spielt das Protein Rasip1 eine wichtige Rolle: «Es sorgt für den Transport der klebrigen Adhäsionsproteine vom Zentrum in die Peripherie der Kontaktflächen und erlaubt so die Lumenbildung zwischen den Zellen», so Erstautor Dr. Jianmin Yin.
Korrekte Gefäßbildung durch Zugkräfte zwischen den Zellen
In einer weiteren Veröffentlichung in «Angiogenesis» beschreibt das Team die Rolle von Kontraktionskräften, die durch die Proteine Heg1 und Ccm1 reguliert werden. «Wir fanden heraus, dass diese Kontraktionskräfte zwischen den Zellen essenziell sind. Nur wenn die Intensität dieser Kräfte genau dosiert ist, interagieren die Zellen auch richtig miteinander und die Gefäßbildung verläuft korrekt», sagt Jianmin Yin.
Die Forschenden entdeckten dabei einen Mechanismus, bei dem koordinierte Zugkräfte entlang der Zellkontakte für eine gleichmäßige Ausdehnung der Blutgefäße sorgt. «Wir fanden heraus, dass winzige Kräfte durch das rhythmische Zusammenziehen der Zellstrukturen dabei helfen, die Zellverbindungen zu stabilisieren und dadurch die Form der Zellen erhalten», sagt Heinz Georg Belting, der die Studie geleitet hat. Durch gezielte Aktivierung dieser Kräfte gelang es den Forschenden auch, fehlerhafte Zellverbindungen zu korrigieren. Die Ergebnisse zeigen, wie wichtig diese Kräfte für ein gesundes Gefäßnetzwerk sind.
Neues Verständnis über die Blutgefäßbildung
Erkenntnisse über die spezifische Rolle dynamischer Kräfte und die Regulation durch Proteine erweitern das Verständnis über die Prozesse der Blutgefäßbildung. «Es ist nach wie vor erstaunlich, diesen Vorgang am lebenden Organismus nachverfolgen und neue Rückschlüsse daraus ziehen zu können», so Belting. «Wenn die Kräfteverhältnisse an den Zellkontaktstellen nicht stimmen oder Proteine den Vorgang falsch regulieren, kann sich kein stabiles Zellgerüst entwickeln und es entstehen fehlerhafte Blutgefäße.»
Und so bieten die neuen Forschungsergebnisse auch eine Grundlage für die Entwicklung neuer Strategien zur Behandlung von Gefäßerkrankungen wie beispielsweise Aneurysmen oder arterielle Verschlüsse. Um molekularen Mechanismen bei der Blutgefäßentwicklung noch besser zu verstehen, möchten die Forschenden den Prozess zukünftig auch mit biophysikalischen Methoden genauer untersuchen.
Universität Basel
Originalpublikationen:
Yin, J., Schellinx, N., Maggi, L. et al. Initiation of lumen formation from junctions via differential actomyosin contractility regulated by dynamic recruitment of Rasip1. Nat Commun15, 9714 (2024). https://doi.org/10.1038/s41467-024-54143-y
Yin, J., Maggi, L., Wiesner, C. et al. Oscillatory contractile forces refine endothelial cell-cell interactions for continuous lumen formation governed by Heg1/Ccm1. Angiogenesis27, 845–860 (2024). doi.org/10.1007/s10456-024-09945-5