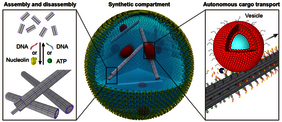
Zytoskelette sind wesentliche Bestandteile jeder Zelle und steuern ihre Form, ihre innere Organisation und andere lebenswichtige Funktionen, wie zum Beispiel den Transport von Molekülen zwischen verschiedenen Teilen der Zelle. Nachdem die Forschenden die Zytoskelette in die synthetischen Tröpfchen eingebracht hatten, konnten sie auch verschiedene Zellfunktionen nachweisen, wie zum Beispiel den Transport von Molekülen oder den Auf- und Abbau von DNA-basierten Strukturen nach bestimmten Auslöseimpulsen. Die Ergebnisse wurden am 20. Juni 2022 in Nature Chemistry veröffentlicht.
Herausforderung, Zytoskelett-Funktionen zu imitieren
Das Zytoskelett ist ein entscheidender Bestandteil jeder Zelle und besteht aus verschiedenen Proteinen. Über die grundlegende Funktion hinaus, der Zelle ihre Form zu geben, ist es für viele zelluläre Prozesse unerlässlich - wie zum Beispiel für die Zellteilung, den intrazellulären Transport verschiedener Moleküle oder die Beweglichkeit als Reaktion auf ein äußeres Signal. Aufgrund seiner bedeutenden Rolle in natürlichen Systemen ist die Möglichkeit, die Funktionsweise des Zytoskeletts auch in einer künstlichen Umgebung zu imitieren, ein wichtiger Schritt hin zu Bau und Gestaltung einer synthetischen Zelle. Dies ist mit vielen Herausforderungen verbunden. Neben der Stabilität gehört dazu auch eine schnelle Anpassungs- und Reaktionsfähigkeit auf Auslöseimpulse.
Forschende im Bereich der synthetischen Biologie haben bereits DNA-Nanotechnologie eingesetzt, um Zellbestandteile nachzubilden, wie zum Beispiel DNA-basierte Nachahmungen von Ionenkanälen oder Linkern zwischen Zellen. Dabei machen sie sich die Tatsache zunutze, dass die DNA so programmiert werden kann, dass sie sich durch komplementäre Basenpaare selbst in einer vorher geplanten Form zusammensetzt.
DNA-Filamente als synthetisches Zytoskelett
„Synthetische DNA-Strukturen ermöglichen hochspezifische und programmierte Aufgaben und eröffnen vielseitige Gestaltungsmöglichkeiten, die über das, was mit den biologisch definierten Mitteln möglich ist, hinausgehen. Insbesondere kann der strukturelle Aufbau der DNA-Strukturen von ihren natürlichen Entsprechungen abweichen und dabei sogar den Funktionsumfang von natürlichen Systemen überschreiten“, sagt Laura Na Liu, Professorin am 2. Physikalischen Institut an der Universität Stuttgart.
Zuvor war es Forschenden wie Paul Rothemund, Elisa Franco oder Rebecca Schulman bereits gelungen, DNA zu Filamenten im Mikrometerbereich (wie eine Perlenkette) zusammenzufügen. Seitdem wurden diese Filamente mit diversen Funktionen ausgestattet, sie reagieren zum Beispiel auf äußere Stimulation, indem sie sich selbst auf- und abbauen können. Wissenschaftlerinnen und Wissenschaftler der Universität Stuttgart und des Max-Planck-Instituts für medizinische Forschung gehen auf dem Weg zur künstlichen Zelle nun einen Schritt weiter, indem sie diese Filamente als synthetisches Zytoskelett nutzen und sie mit weiteren Funktionen ausstatten.
„Es ist spannend, dass wir den Zusammenbau des DNA-Zytoskeletts auch mit dem Molekül ATP auslösen können – demselben Stoff, den Zellen verwenden, um verschiedene Mechanismen anzutreiben, quasi eine Energiequelle“, sagt Kerstin Göpfrich, Forschungsgruppenleiterin am Max-Planck-Institut für medizinische Forschung.
Ziel, Vesikeltransport zu beschleunigen
Darüber hinaus induzierten die Forschenden den Transport von Vesikeln entlang der Filamente mit Hilfe des „Burnt Bridge“-Mechanismus, der von Khalid Salaita entwickelt wurde. Dieser Mechanismus ahmt den Vesikeltransport entlang von Teilen des natürlichen Zytoskeletts in Zellen, den Mikrotubuli, nach. „Im Vergleich zum Transport in lebenden Zellen ist der Transport entlang unserer DNA-Filamente immer noch langsam. Ihn zu beschleunigen ist eine Herausforderung für die Zukunft“, sagt Kevin Jahnke, einer der Erstautoren der Veröffentlichung und Postdoc in Kerstin Göpfrichs Gruppe am Max-Planck-Institut für medizinische Forschung.
Pengfei Zhan, Postdoc in der Gruppe von Prof. Laura Na Liu in Stuttgart, fügt hinzu: „Es war eine besondere Herausforderung, das energetische Umfeld für den Auf- und Abbaufähigkeiten richtig einzustellen.“ Eine noch stärkere Funktionalisierung der DNA-Filamente wird in Zukunft entscheidend sein, um natürliche Zellen noch besser nachahmen zu können. Dadurch könnte man künstliche Zellen herstellen, um zelluläre Mechanismen genauer zu untersuchen oder neue Therapieansätze zu entwickeln.
Universität Stuttgart
Originalpublikation:
Zhan, P., Jahnke, K., Liu, N. et al. Functional DNA-based cytoskeletons for synthetic cells. Nat. Chem. (2022). doi.org/10.1038/s41557-022-00945-w