Aus embryonalen Stammzellen von Knochenfischen kann in der Petrischale komplexes Netzhautgewebe gezüchtet werden. Das hat ein Forscherteam vom Centre for Organismal Studies (COS) der Universität Heidelberg demonstriert. Bislang werden in der Organoid-Forschung Stammzellen von Säugetieren einschließlich des Menschen verwendet. Die Wissenschaftler unter Leitung von Prof. Dr. Joachim Wittbrodt konnten nun erstmals zeigen, dass auch Stammzellen von Medaka- und Zebrafischen unter kontrollierten Laborbedingungen hoch organisierte neurale Strukturen ausbilden. Hiervon erhoffen sich die Forscher unter anderem neue Erkenntnisse zu den grundlegenden Mechanismen der Netzhautentwicklung.
Organoide sind kleine Gewebestücke, die aus Stammzellen gewonnen werden und echten Organen ähneln. Sie werden in der Grundlagenforschung eingesetzt, um neue Erkenntnisse zu Zellorganisation und Organentwicklung zu gewinnen, die Entstehung von Krankheiten zu untersuchen oder um neue Medikamente zu entwickeln und zu testen. „Der große Vorteil von Fisch-Organoiden besteht darin, dass sie im Gegensatz zu Organoiden aus Säugetierstammzellen sehr reproduzierbar sind. Sie entwickeln sich zuverlässig und sehr schnell und ermöglichen den direkten Vergleich mit lebenden Embryonen, die bei Fischen außerhalb des Mutterleibs heranwachsen“, erklärt Prof. Wittbrodt, Leiter der Forschungsgruppe für Tierphysiologie und Entwicklungsbiologie am COS. „Dadurch können wir die molekularen und genetischen Mechanismen der Retinabildung fast ingenieurwissenschaftlich manipulieren.“
Vorgängerstudien mit Stammzellen von Zebrafischen hatten bereits darauf hingedeutet, dass diese bei entsprechender Kultivierung bestimmte Stadien der Embryonalentwicklung durchlaufen. Bislang ist den Heidelberger Wissenschaftlern jedoch kein Experiment bekannt, in dem sich Zellkulturen aus Fischen erfolgreich zu hochkomplexen neuralen Strukturen wie der Retina organisiert haben. „Unsere Studie schließt diese Lücke in der Organoid-Forschung“, betont Dr. Lucie Zilova, Postdoktorandin in der Gruppe von Joachim Wittbrodt. „Es ist uns gelungen, die Stammzellen von Knochenfischen so zu kultivieren, dass sie in etwas weniger als einer Woche einen erstaunlichen Entwicklungsprozess durchlaufen haben. Am Ende stand eine hoch organisierte Netzhautstruktur.“
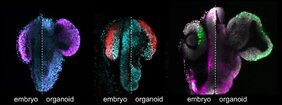
Das Heidelberger Team nutzte hierfür pluripotente Stammzellen von Medaka- und Zebrafischembryonen. Dabei handelt es sich um Zellen, die noch nicht ausdifferenziert sind und sich potenziell zu vielen verschiedenen Zelltypen entwickeln können. Nach Angaben von Dr. Zilova schlossen sich alle einem einzigen Embryo entnommenen Zellen selbstständig innerhalb von nur 24 Stunden zu einer großen Retina zusammen. Diese bildete anschließend in einem Zeitraum von wenigen Tagen verschiedene, in Lagen organisierte Zelltypen aus, die auch im Fischauge zu finden sind – darunter Photorezeptorzellen, bipolare Zellen, Amakrinzellen und Ganglienzellen. „Der Entwicklungsprozess erwies sich als unglaublich effizient“, sagt die Wissenschaftlerin. So entstanden innerhalb eines Tages hunderte von kleinen Netzhaut-Organoiden. Mit dem hohen Durchsatz konnten die Forscher genau eingrenzen, unter welchen Bedingungen sich Strukturen herausbilden, die einem Kopf mit zwei Augen ähneln, also sowohl Gehirn- als auch Netzhautbereiche entwickeln.
„Nur weil eine organoide Struktur so aussieht wie eine Netzhaut, bedeutet das jedoch nicht, dass sich die Zellen auch so verhalten und entwickeln, wie im lebenden Embryo“, ergänzt Dr. Venera Weinhardt, ebenfalls Postdoktorandin am COS. Um diese Frage zu beantworten, verglichen die Wissenschaftler mithilfe von Lichtscheibenfluoreszenzmikroskopie – einem bildgebenden Verfahren, das entsprechende Beobachtungen in Echtzeit ermöglicht – das Verhalten der Zellen in der Kultur mit dem Verhalten der Zellen im Embryo. „Die Analyse zeigte klar, dass es hier keine Unterschiede gibt. Die Zellen bewegen sich sowohl in der Kultur als auch im Embryo entlang bestimmter Routen zur äußeren Peripherie des Augenvorläufers und schließen sich dort zum sogenannten Augenbläschen zusammen“, erläutert Dr. Weinhardt.
Die Heidelberger Forscher beobachteten außerdem, dass sich die Organoide aus den evolutionär unterschiedlichen Medaka- und Zebrafischen stark ähneln. Daraus schließen sie, dass die molekularen und genetischen Mechanismen der frühen Augenentwicklung über verschiedene Spezies hinweg und unabhängig von Umgebungseinflüssen, denen die embryonalen Zellen während ihrer Entwicklung ausgesetzt sind, evolutionär erhalten geblieben sind. Offen ist ebenfalls noch die Frage, ob embryonale Stammzellen in der Kultur auch weitere organoide Strukturen über die Netzhaut hinaus bilden können.
Die Forschungsergebnisse wurden im Journal „eLife“ veröffentlicht. Die Arbeiten zur Studie wurden im Rahmen des Horizon-2020-Programms der Europäischen Union, von der Deutschen Forschungsgemeinschaft und von der Carl-Zeiss-Stiftung gefördert.
(Universität Heidelberg)
Originalpublikation:
L. Zilova, V. Weinhardt, T. Tavhelidse, C. Schlagheck, T. Thumberger, J. Wittbrodt: Fish primary embryonic pluripotent cells assemble into retinal tissue mirroring in vivo early eye development, eLife (12 July 2021), https://doi.org/10.7554/eLife.66998