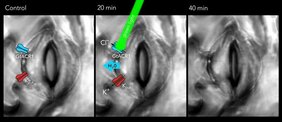
Pflanzen besitzen an der Oberfläche ihrer Blätter mikroskopisch kleine Poren, die sogenannten Stomata. Mit deren Hilfe regulieren sie den Einstrom von Kohlendioxid für die Photosynthese. Mit deren Hilfe verhindern sie auch, dass sie bei Trockenheit zu viel Wasser verlieren oder gar verdorren.
Die Stomata sind von jeweils zwei Schließzellen umlagert. Sinkt der Innendruck dieser Zellen, erschlaffen sie und verschließen die Pore. Steigt der Druck, weichen die Zellen auseinander und die Porenöffnung weitet sich.
Reguliert werden diese Bewegungsabläufe in den Schließzellen. Dort laufen Signalwege ab, die so komplex sind, dass der Mensch hier nicht direkt eingreifen kann. Ein Forschungsteam von der Julius-Maximilians-Universität (JMU) Würzburg hat jetzt aber eine Möglichkeit gefunden, die Bewegung der Stomata berührungslos zu steuern – mit Lichtpulsen.
Lichtempfindliches Protein aus Algen verwendet
Das gelang den Forschern, indem sie einen lichtempfindlichen Schalter in die Schließzellen von Tabakpflanzen einbauten. Diese Technologie stammt aus der Optogenetik. Sie ist für tierische Zellen seit Jahren etabliert, für Pflanzenzellen steckt sie noch in den Kinderschuhen.
Das Team um den JMU-Biophysiker und Schließzellexperten Professor Rainer Hedrich beschreibt seine Vorgehensweise im angesehenen Wissenschaftsjournal Science Advances. Maßgeblich beteiligt waren die JMU-Forscher Shouguang Huang (Erstautor), Kai Konrad und Rob Roelfsema.
Als Lichtschalter verwendete die Gruppe ein lichtempfindliches Protein aus der Alge Guillardia theta, und zwar den Anionenkanal ACR1 aus der Gruppe der Channelrhodopsine. Auf Lichtimpulse hin sorgt der Schalter dafür, dass Chlorid aus den Schließzellen hinausströmt und Kalium nachfolgt. Die Schließzellen verlieren an Innendruck, erschlaffen und die Pore geht innerhalb von 15 Minuten zu. „Der Lichtpuls ist wie eine Fernbedienung für die Bewegung der Stomata”, sagt Hedrich.
Anionenkanal-Hypothese bestätigt
„Durch die Belichtung von ACR1 haben wir die zelleigene Signalkette überbrückt und damit die Annahme bewiesen, dass die Öffnung von Anionenkanälen essentiell und ausreichend für den Stomaschluss ist“, fasst Hedrich die Ergebnisse der Studie zusammen. Durch die Belichtung sei die Transpiration der Pflanzen fast komplett unterbunden worden.
Mit diesem Wissen könne man jetzt darangehen, Pflanzen mit einer erhöhten Zahl schließzelleigener Anionenkanäle zu züchten. Derart ausgestattete Pflanzen sollten auf anrollenden Hitzewellen hin schneller ihre Stomata schließen und so Dürreperioden besser bewältigen können.
„Pflanzliche Anionenkanäle werden bei Stress aktiviert; dieser Prozess ist abhängig von Kalzium. In einem folgenden Optogenetik-Projekt wollen wir kalziumleitende Kanalrhodopsine verwenden, um durch Belichtung gezielt Kalzium in die Schließzelle einströmen zu lassen und den Mechanismus der Anionenkanal-Aktivierung im Detail zu verstehen“, skizziert Hedrich die kommenden Ziele seiner Forschung.
Die wissenschaftliche Grundlagenforschung kann von den Ergebnissen aus Würzburg ebenfalls profitieren: „Unser neues optogenetisches Werkzeug hat enormes Potenzial für die Forschung“, sagt der JMU-Professor. „Mit ihm können wir neue Einsichten gewinnen, wie Pflanzen ihren Wasserverbrauch regulieren und wie die Fixierung von Kohlendioxid und die Bewegungen der Stomata gekoppelt sind.“
Universität Würzburg
Originalpublikation:
Shouguang Huang, Meiqi Ding, M. Rob G. Roelfsema, Ingo Dreyer, Sönke Scherzer, Khaled A. S. Al-Rasheid, Shiqiang Gao, Georg Nagel, Rainer Hedrich, Kai R. Konrad: Optogenetic control of the guard cell membrane potential and stomatal movement by the light-gated anion channel GtACR1, Science Advances, 9. Juli 2021, DOI: 10.1126/sciadv.abg4619