Nahezu alle Zellen des menschlichen Körpers besitzen innere Uhren, die für die zeitliche Steuerung wichtiger Organfunktionen zuständig sind. Der sogenannte zirkadiane Tagesrhythmus dieser biologischen Uhren unterscheidet sich jedoch leicht von Zelle zu Zelle, sodass diese zur Angleichung miteinander kommunizieren müssen. „Fehlt dieser Austausch der Zellen untereinander, kann die zeitliche Koordination wichtiger biologischer Funktionen der Gewebe gestört werden. Das kann beispielsweise Risiken für Stoffwechselerkrankungen steigern“, erklärt Prof. Dr. Achim Kramer, Studienleiter und Leiter des Arbeitsbereichs Chronobiologie am Institut für Medizinische Immunologie der Charité. Während die interzelluläre Kommunikation im sogenannten Nucleus suprachiasmaticus – einem Kerngebiet des Gehirns im Hypothalamus, das für die Anpassung der inneren Uhren an den täglichen Licht-Dunkel-Rhythmus zuständig ist – bereits recht gut erforscht ist, gab die Synchronisierung innerer Uhren innerhalb anderer Körpergewebe noch immer Rätsel auf. Das Team um Prof. Kramer hat daher untersucht, ob und auf welche Weise diese zellulären inneren Uhren abseits des Gehirns durch sogenannte Kopplung interagieren, um ihre Rhythmen abzustimmen.
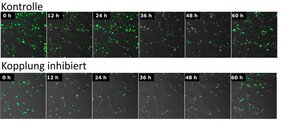
Anhand zellulärer Modelle verschiedener Gewebe ging das Forschungsteam der Frage nach, welche biologischen Mechanismen dieser Kommunikation zugrunde liegen und welche Konsequenzen eine gestörte Rhythmusangleichung in Zellverbänden hat. „Für unsere Messungen zellulärer Rhythmik haben wir sogenannte Reportergene genutzt, die biolumineszierende oder fluoreszierende Signale generieren. Mit deren Hilfe war es uns möglich zu untersuchen, ob zelluläre innere Uhren ihre Rhythmen einander angleichen können“, sagt Dr. Anna-Marie Finger, Erstautorin der Studie und Chronobiologin am Institut für Medizinische Immunologie der Charité. In Zusammenarbeit mit Dr. Robert Hurwitz vom Max-Planck-Institut für Infektionsbiologie nutzte das Team Chromatographie- und Massenspektrometrie-Methoden, um mögliche Proteinfaktoren nachzuweisen, die eine Synchronisierung innerer Uhren ermöglichen. „Wir haben dabei herausgefunden, dass diese zellulären Uhren über freigesetzte Proteine kommunizieren: Der Wachstumsfaktor ‚Transforming Growth Factor beta‘ (TGF-ß) wird von Zellen abgegeben und treibt die Synchronisierung dieser inneren Uhren an, indem er die Produktion des zentralen Regulatorproteins PER2 regelt“, erklärt Dr. Finger. „Eine Störung des TGF-ß-Signalweges mithilfe pharmakologischer und genetischer Methoden führte zu einer verminderten Rhythmik auf Einzelzell- und Gewebsebene wie auch zu einer erhöhten Anfälligkeit der inneren Uhren gegenüber äußeren Störfaktoren.“ Diese Beobachtung zeigt, wie zentral dieser Kommunikationsweg für die Synchronität innerer Uhren auf Gewebeebene und somit für die zeitliche Steuerung von Organfunktionen ist.
„Eine Störung dieser Kopplung der zellulären inneren Uhren könnte dazu beitragen, dass wichtige biologische Funktionen der Gewebe zur falschen Tageszeit stattfinden und somit krankmachende Prozesse begünstigen“, erklärt Prof. Kramer. „So könnte etwa eine mangelhafte Synchronisierung von Alpha- und Beta-Zellen der Bauchspeicheldrüse zu einem gestörten Rhythmus der Glucagon- und Insulinproduktion führen und somit die Entstehung diabetischer Erkrankungen begünstigen.“ Um herauszufinden, welche rhythmischen Prozesse in verschiedenen Organen durch eine Störung des TGF-ß-Signalweges betroffen sind, werden die Forschenden die interzelluläre Kommunikation innerer Uhren mithilfe weiterer Modelle nachverfolgen. Dadurch versprechen sie sich Erkenntnisse darüber, welche Bedeutung Störungen der inneren Uhren für die Entstehung von Krankheiten haben können.
Charité – Universitätsmedizin Berlin
Originalpublikation:
Finger AM et al. Intercellular coupling between peripheral circadian oscillators by TGF-β signaling. Sci Adv (2021), doi: 10.1126/sciadv.abg5174