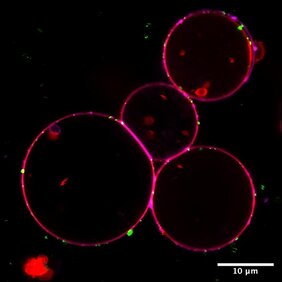
Mal wieder den Hausputz aufgeschoben, der Kellerraum läuft von Sperrmüll über? Diese Aufschieberitis beim klar Schiff machen können sich lebende Zellen nicht erlauben. Winzige Müllschlucker sind dort ständig aktiv, um ausgediente Proteine, fehlerhafte Zellbausteine oder defekte Organellen zu beseitigen. Diese Müllschlucker, Autophagosomen genannt, fischen die ausgedienten Bestandteile heraus, bevor sie sich in der Zelle anhäufen und Schaden anrichten. Der zelluläre Müll wird dann an die zelleigene Recycling-Maschinerie, das Lysosom, weitergegeben, dort verdaut und wiederverwertet. So hat die Zelle rasch wieder Bausteine verfügbar für neue Zellkomponenten. Der Autophagie-Prozess, wörtlich Selbstfressen, trägt so auch dazu bei, dass Zellen Stress oder Hungerszeiten überstehen.
Die Autophagie erfüllt aber noch einen anderen wichtigen Zweck. Sie macht Viren und Bakterien unschädlich, die die Abwehr des Immunsystems erfolgreich umgehen und bis ins Zellplasma gelangen. Entsprechend fatal sind die Folgen, wenn der Autophagie-Prozess fehlerhaft, zu langsam oder zu schnell abläuft. Es können sich neurodegenerative Erkrankungen und Krebs entwickeln oder Störungen des Immunsystems auftreten. Auch Alterungsprozesse scheinen sich zu beschleunigen.
„Die Autophagie ist ein hochkomplexer Vorgang, an dem viele verschiedene Proteine und Proteinkomplexe beteiligt sind. Viele davon kennen wir, doch es gibt noch fundamentale Wissenslücken“, berichtet Alex Faesen, Forschungsgruppenleiter am Göttinger Max-Planck-Institut (MPI) für Multidisziplinäre Naturwissenschaften. „Wie arbeiten die Proteinkomponenten zusammen? Wie wird der Prozess der Autophagie gestartet und gestoppt? Wann und wo wird das Autophagosom zusammengebaut? Das wollen wir herausfinden.“
Nanomaschine am Werk
Seinem Team gelang es nun erstmals, sämtliche in den Autophagie-Prozess involvierten Proteine im Labor zu produzieren und sie beim Zusammenbau der Autophagosomen direkt zu beobachten. Ein mehrjähriges Mammutprojekt der gesamten Forschungsgruppe, die dazu mit den Teams um Björn Stork von der Universität Düsseldorf und Michael Meinecke, jetzt am Heidelberg University Biochemistry Center, kooperierte. „Herausforderungen gab es dabei viele“ berichtet der Göttinger Biochemiker. Im ersten Schritt stellten die Wissenschaftler*innen jede einzelne Proteinkomponente im Labor her. Standardmäßig nutzt man hierbei Bakterien, die genetisch so umprogrammiert werden, dass sie das gewünschte Protein in größerer Menge herstellen. „Doch die Proteinherstellung mit Bakterien funktionierte für keines unserer Proteine“, sagt Faesen. Stattdessen wechselten die Forschenden auf Insektenzellen als molekulare Helfer – der Durchbruch.
Im nächsten Schritt brachte das Team die einzelnen Proteinkomplexe zusammen. „Die Komplexe lagerten sich von selbst zu einem Proteinsuperkomplex, dem Autophagie-Initiationskomplex, zusammen. Tatsächlich ist bei der Autophagie eine ausgeklügelte, zelluläre Nanomaschine am Werk – und sie arbeitet ganz anders als bisher gedacht“, so der Gruppenleiter.
Um Autophagosomen herzustellen, schafft der Autophagie-Initiationskomplex zunächst eine Verbindungsstelle zwischen einer bestimmten Struktur der Zelle, dem Endoplasmatischen Retikulum, und dem sich bildenden Autophagosom. Unter Stress oder in Hungerzeiten wie beim Ausdauersport geschieht dies innerhalb von nur wenigen Minuten. „Ab diesem Punkt gibt es kein Zurück mehr: Der Müllschlucker wird zusammengebaut und sammelt den zellulären Abfall ein“, erklärt Anh Nguyen, einer der beiden Erstautor*innen der jetzt in Molecular Cell veröffentlichten Studie. Miterstautorin Francesca Lugarini ergänzt: „Über die Kontaktstelle werden fettartige Moleküle, sogenannte Lipide, in eine Vorläuferstufe der Autophagosomen transportiert und dort eingebaut.“ Diese wachsen und umschließen dabei das abzubauende Zellmaterial – es entsteht das fertige Mini-Organell. Innerhalb von nur knapp 20 Minuten nach dessen Bildung liefert das Autophagosom bereits seinen Abfall an das Lysosom, indem es mit diesem verschmilzt.
Protein-Origami für „An“ und „Aus“
Doch was startet den Zusammenbau der Autophagie-Maschine, was startet und was stoppt sie? Einen molekularen „An“- und „Aus“-Schalter wie bei anderen molekularen Maschinen fanden die Forschenden nicht. Diese wird stattdessen mittels „Protein-Origami“ in Gang gesetzt und angehalten. Bestimmte Moleküle, ATG13 und ATG101 genannt, ändern dafür ihre Form. Dies beeinflusst, wie sie an andere Proteine der Nanomaschine binden. „Diese Proteinumwandlung gibt auch den Startschuss für den Zusammenbau des Autophagie-Initiationskomplexes zur richtigen Zeit und am richtigen Ort“, beschreibt Faesen die Besonderheiten der Nanomaschine.
Die Wissenschaftler*innen erhoffen sich von den neuen Erkenntnissen, die Entwicklung zukünftiger Wirkstoffe voranzubringen, mit denen sich Erkrankungen behandeln lassen, die auf einem fehlerhaften Autophagie-Prozess beruhen.
Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Originalpublikation:
Nguyen, A.; Lugarini, F.; David, C.; Hosnani, P.; Alagöz, Ç.; Friedrich, A.; Schlütermann, D.; Knotkova, B.; Patel, A.; Parfentev, I.; Urlaub, H.; Meinecke, M.; Stork, B.; Faesen, A. C.: Metamorphic proteins at the basis of human autophagy initiation and lipid transfer. Mol Cell 83, 1-14 (2023).
https://doi.org/10.1016/j.molcel.2023.04.026