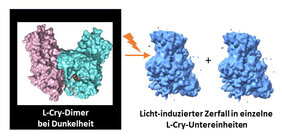
Diese Fähigkeit ist für die Würmer entscheidend, um ihre Fortpflanzung mit Hilfe eines inneren Mondkalenders, auch circalunare Uhr genannt, mit der Mondphase zu synchronisieren, ohne dabei durch den Tag-Nacht-Zyklus durcheinandergebracht zu werden. Die Forschenden in Köln nutzten die Methode und die vor Ort vorhandene Plattform der Kryo-Elektronenmikroskopie, um die dreidimensionale Struktur des L-Cry-Proteins unter verschiedenen Belichtungszuständen sichtbar zu machen. Diese strukturellen Analysen sowie die vor allem in Mainz durchgeführten biochemischen Untersuchungen enthüllten, dass L-Cry im Dunkeln eine sogenannte dimere Anordnung mit zwei stabil verknüpften Untereinheiten annimmt, aber durch intensive, sonnenlichtartige Belichtung in seine Untereinheiten aufgetrennt werden kann.
Nicht nur die räumliche Anordnung der beiden Untereinheiten im dunklen Zustand ist außergewöhnlich, denn sie wurde bisher bei anderen Cry-Proteinen nicht beobachtet. Auch die Richtung des Übergangs zwischen den lichtabhängigen Zuständen ist unerwartet, da für andere Cry-Proteine bisher nur der umgekehrte Prozess beschrieben wurde: von einzelnen Untereinheiten im Dunkeln zu mehreren assoziierten Untereinheiten im Hellen. Das Forschungsteam konnte weiterhin die für dieses ungewöhnliche Verhalten wichtigen strukturellen Merkmale im Protein identifizieren. Zudem ermöglichte die Kenntnis der dreidimensionalen Struktur, durch Mutationen gezielte Veränderungen an dem L-Cry Protein vorzunehmen, wodurch dessen Funktion als Lichtrezeptor weitergehend aufgeklärt werden konnte. „Anhand dieser Erkenntnisse lässt sich erklären, wie es L-Cry gelingen könnte, zwischen Sonnen- und Mondlicht zu unterscheiden: Das intensive Sonnenlicht aktiviert im Protein immer beide Untereinheiten gleichzeitig, was den Zerfall des Dimers in die einzelnen Untereinheiten einleitet. Im deutlich schwächeren Mondlicht hingegen wird statistisch immer nur eine von zwei Untereinheiten aktiviert“, sagt Prof. Dr. Eva Wolf vom Institut für Molekulare Physiologie der JGU, die die Studie auf Mainzer Seite leitete. Die Ergebnisse der Studie unterstreichen die Einzigartigkeit von L-Cry unter den funktionell sehr vielfältigen Cry-Proteinen, von denen unter anderem auch angenommen wird, dass sie bei der Magnetrezeption von Vögeln als Sensorproteine dienen.
Die Entschlüsselung der molekularen Prozesse des inneren Mondkalenders hat begonnen
„Die Arbeit mit lichtsensitiven Proteinen ist immer eine Herausforderung“, sagt Hong Ha Vu, Doktorand in der Arbeitsgruppe von Prof. Dr. Eva Wolf, der maßgeblich an der Studie beteiligt war. „Schon bei der Herstellung der L-Cry-Proteine müssen wir alle experimentellen Schritte im Dunkeln oder unter gut definierten Rotlichtbedingungen durchführen, um eine unbeabsichtigte Vorab-Aktivierung der sehr lichtempfindlichen Proteine zu verhindern. Für die funktionelle Charakterisierung von L-Cry ist es zudem wichtig, Belichtungsbedingungen zu wählen, die möglichst genau dem natürlichen Sonnenlicht oder dem Mondlicht unter der Wasseroberfläche entsprechen, wie es die Borstenwürmer in ihrer natürlichen Umgebung vorfinden. Nur so können wir die besonderen Eigenschaften von L-Cry als Sonnen- und Mondlichtrezeptor im Vergleich zu anderen Cryptochromen umfassend beschreiben.“ Prof. Dr. Eva Wolf ergänzt: „Unsere Untersuchungen haben wichtige neue Einblicke in die Funktionsweise dieses außergewöhnlichen Sonnen- und Mondlichtrezeptors geliefert. Mit L-Cry haben wir zudem erstmalig ein Protein mit einer Funktion bei der Synchronisation des inneren Mondkalenders mit den Mondphasen auf struktureller und molekular-mechanistischer Ebene beschrieben. Unsere Erkenntnisse eröffnen neue wissenschaftliche Ansätze für die zukünftige Erforschung der weitgehend noch unbekannten molekularen Prozesse, die den inneren Mondkalendern und deren Synchronisation mit dem Mondzyklus zugrunde liegen.“
Johannes Gutenberg-Universität Mainz
Originalpublikation:
H. H. Vu et al., A marine cryptochrome with an inverse photo-oligomerization mechanism, Nature Communications 14, 6918, 30. Oktober 2023,
https://doi.org/10.1038/s41467-023-42708-2