Proteinfaltungshelfer Chaperonin
Proteine sind für praktisch alle Lebensfunktionen in Zellen verantwortlich. Um ihre vielfältigen Funktionen auszuüben, müssen sie - ähnlich wie Bauteile in Maschinen - eine bestimmte dreidimensionale Struktur aufweisen. Proteinfaltungshelfer unterstützen neu hergestellte Proteinen dabei, ihre funktionelle Form einzunehmen.
Biochemiker Ulrich Hartl, Direktor am MPI für Biochemie erklärt: „Ich beschäftige mich schon seit über 30 Jahren mit den Chaperoninen. Diese Proteinkomplexe kommen in fast allen Lebewesen unverändert vor und sind für die korrekte Faltung der Proteine essenziell. Fehlerhaft gefaltete Proteine sind zum Beispiel mit Krankheiten wie Alzheimer und Parkinson assoziiert. Je mehr wir über die Strukturen der Chaperonine wissen, desto genauer können wir ihre Funktionen und Fehlfunktionen verstehen und neue Strategien für die Behandlung dieser Krankheiten entwickeln.“
Damit die genaue Funktionsweise der Chaperonine noch besser verstanden wird, hat sich Ulrich Hartl mit weiteren Experten zusammengetan, wie dem Strukturbiologen Wolfgang Baumeister, Emeritus-Direktor und Erfinder der Kryo-ET am MPI für Biochemie, sowie dem Strukturbiologen Rubén Fernandez Busnadiego vom Institut für Neuropathologie der Universitätsmedizin Göttingen (UMG) und Mitglied des Exzellenzclusters „Multiscale Bioimaging: From Molecular Machines to Networks of Excitable Cells“ (MBExC).
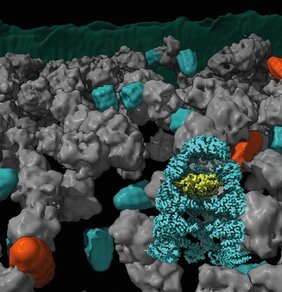
Chaperonin-Komplex
Chaperonin-Komplexe bestehen aus zwei verschiedenen Untereinheiten, GroEL und GroES. Dabei besteht GroEL aus zwei übereinanderliegenden Proteinringen, die einen Zylinder bilden. GroES fungiert wie ein Deckel für den GroEL-Zylinder. Neu hergestellte Proteine werden im nanometergroßen Innenraum des GroEL eingekapselt und können sich falten während sie von der zellulären Umgebung abgeschirmt sind.
Die Forscher konnten zwei Hauptformen des GroEL-GroES-Komplexes in den Zellen nachweisen, die als „Bullet“ und „Football“ (benannt nach der Form eines American Football) bezeichnet werden. Die beiden Formen unterscheiden sich durch ihre strukturelle Symmetrie. Bei der Bullet-Form ist eine GroES-Kappe nur an eine Seite des GroEL-Fasses gebunden. Diese Form wurde vor allem in Bakterien bei normalem Wachstum gefunden. Darüber hinaus wurden auch Football-Komplexe nachgewiesen. Die mikroskopischen Bilder zeigten auch, dass sich die zu faltenden Proteine im Chaperonin-Fass befanden. Jonathan Wagner, Erstautor der Studie und Wissenschaftler in Martinsried und Göttingen, sagt: „Es ist faszinierend, dass die Kryo-Elektronenmikroskopie inzwischen so weit fortgeschritten ist, dass wir Prozesse wie die Proteinfaltung in lebenden Zellen so detailliert verfolgen können“.
Rubén Fernandez Busnadiego beschreibt: „In dieser Studie haben wir die Kryo-ET mit der Einzelpartikel-Kryo-Elektronenmikroskopie (Kryo-EM) und der quantitativen Massenspektrometrie kombiniert. Auf diese Weise konnten wir verschiedene Konformationen von Chaperonin-Komplexen in verschiedenen Zellzuständen beobachten und ihre Häufigkeit bestimmen. Die Möglichkeit, diese Komplexe direkt im Bakterium und nicht nur im Reagenzglas sichtbar zu machen, stellt einen großen Fortschritt auf diesem Gebiet dar und ist erst seit kurzem möglich. Der Chaperoninkomplex ist nur 14 Nanometer breit. In Jahrzehnten von Experimenten mit gereinigten GroEL/ES-Komplexen wurden widersprüchliche Ergebnisse über die Funktionsweise dieser Maschinerie erzielt. Dies ist wahrscheinlich darauf zurückzuführen, dass In-vitro-Experimente die Bedingungen in der Zelle nicht vollständig nachbilden können. Dieses Wiedersprüche können wir nun durch zelluläre Kryo-ET ausräumen, da wir die Komplexe in ihrer nativen Umgebungen mit hoher Auflösung visualisieren.“
Abschließend fasst Ulrich Hartl zusammen: „Die Ergebnisse deuten darauf hin, dass sich bei der Chaperonin-unterstützten Proteinfaltung die Chaperonine unterschiedlich zusammenlagern und in einem Reaktionszyklus zwischen der Bullet- und der Football-Form wechseln. In zukünftigen Arbeiten werden wir uns darauf konzentrieren, die Zwischenzustände dieser Zyklen zu klären, um zu verstehen, wie sie durch die chemischen Reaktionen der ATP-Bindung und Hydrolyse reguliert werden.“
Max-Planck-Institut für Biochemie
Originalpublikation:
Jonathan Wagner, Alonso I. Carvajal, Andreas Bracher, Florian Beck, William Wan, Stefan Bohn, Roman Körner, Wolfgang Baumeister, Rubén Fernández-Busnadiego, F.-Ulrich Hartl: Visualizing chaperonin function in situ by cryo-electron tomography, Nature, August 2024, https://www.nature.com/articles/s41586-024-07843-w