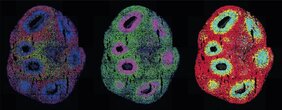
Sie sehen aus wie Gewitterwolken im Stecknadelkopf-Format: Organoide. Die dreidimensionalen Zellkulturen spielen eine bedeutende Rolle in der medizinischen und klinischen Forschung, weil sie in der Petrischale Gewebestrukturen und Organfunktionen nachbilden. Wissenschaftler*innen können an ihnen nachvollziehen, wie Krankheiten entstehen, sich Organe entwickeln oder Medikamente wirken. Mithilfe von Einzelzelltechnologien dringen sie dabei bis zur molekularen Ebene der Zellen vor. Dank der räumlichen Transkriptomik können sie sogar in 3D beobachten, welche Gene an welcher Stelle im Organoid im Verlauf der Zeit aktiv sind.
Die „Miniatur-Organe“ werden meist aus Stammzellen entwickelt. Das sind Zellen, die noch nicht oder kaum differenziert sind. Sie können sich in jedweden Zelltyp entwickeln, etwa in Herz- oder Nierenzellen, Muskelzellen oder Neuronen. Wissenschaftler*innen „füttern“ sie dafür mit Wachstumsfaktoren und betten sie in eine Nährlösung ein. Dort ballen sie sich zu winzigen Zellklumpen zusammen, in denen sie schließlich so funktionieren und interagieren, als befänden sie sich einem echten Gewebe. Diesen Prozess zu steuern, war bislang kaum möglich. Forschende um Professor Nikolaus Rajewsky, Direktor des Berliner Instituts für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB), beschreiben nun im Fachjournal „Nature Methods“ eine Technologie, mit der sie ihn anstoßen, kontrollieren und in räumlicher und zeitlicher Auflösung beobachten können. „Wir haben dafür die räumliche Transkriptomik mit der Optogenetik kombiniert“, sagt Erstautor Dr. Ivano Legnini. „Damit sind wir nicht nur in der Lage, die Genexpression in lebenden Zellen zu kontrollieren, sondern auch, ihren Verlauf zu beobachten.“
Lichtsensoren aktivieren oder blockieren Gene
In der Optogenetik werden natürliche oder künstlich hergestellte „Lichtsensoren“ in Zellen eingefügt. Fällt Licht auf die Sensoren, aktivieren oder blockieren sie die Gene in den Zellen – je nachdem, wie sie programmiert sind. Legnini baute solche Lichtsensoren in aus Stammzellen entwickelten Vorläuferzellen von Neuronen ein, die sich zu neuralen Organoiden zusammenfügen sollten. Dabei arbeitete er mit dem Team der Technologie-Plattform Organoide unter der Leitung von Dr. Agnieszka Rybak-Wolf und der Gruppe „Systembiologie der Differenzierung von neuronalen Zellen und Geweben“ von Dr. Robert Patrick Zinzen zusammen. Die Forschenden wollten nachvollziehen, wie sich das Nervensystem im menschlichen Embryo entwickelt. Dabei spielen Morphogene eine Schlüsselrolle – Moleküle, die den neuronalen Vorläuferzellen signalisieren, ob sie zum Beispiel Neuronen im vorderen Teil des Gehirns oder im hinteren Teil des Rückenmarks werden sollen. Die Kombination dieser Moleküle erzeugt während der Entwicklung typische Muster der Genexpression.
Mithilfe des Lichts aktivierten die Forschenden eines dieser Morphogene, nämlich Sonic-Hedgehog (SHH). Die anschließenden räumlich aufgelösten Einzelzell-Analysen zeigten, dass sich die Zellen daraufhin zu typisch gemusterten Organoiden anordneten. Den Lichtimpuls erzeugten die Forschenden auf zwei Wegen: entweder mithilfe eines Laser-Mikroskops oder mit einem digitalen Mikrospiegel-Mikroskop, das Rajewskys Gruppe zusammen mit Dr. Andrew Woehler entwickelt hat. Andrew Woehler leitete zu diesem Zeitpunkt die Lichtmikroskopie-Plattform des Max Delbrück Center; seit November 2022 steht er der Abteilung für experimentelle Technologien am Howard Hughes Medical Institute in Ashburn, USA, vor. In dieses spezielle Mikroskop wird ein Chip mit mehreren Hunderttausend winzigen Spiegeln eingelegt. Diese können so programmiert werden, dass das Mikroskop – anders als mit einem Laser, der jeweils nur einen einzigen Punkt trifft – komplexe Beleuchtungsmuster auf einer Probe erzeugen kann.
Präzise – mit Verbesserungspotenzial
„Mit unserer Methode können wir Prozesse, die mit Genexpression in Geweben zu tun haben, sehr präzise in der Petrischale reproduzieren“, sagt Ivano Legnini. Seit März dieses Jahres baut er an der Human Technopole in Mailand eine eigene Arbeitsgruppe auf. Dort will er unter anderem die räumliche und zeitliche Auflösung der Technologie verbessern und sie für andere Organoide anwendbar machen.
Auch Nikolaus Rajewsky will weiter an der Methode feilen: „Ich freue mich sehr auf die Zusammenarbeit mit Optogenetik-Experten, um die Technologie weiter zu verbessern und sie auf klinisch relevante menschliche Organoidmodelle anzuwenden.“
Max-Delbrück-Centrum für Molekulare Medizin
Originalpublikation:
Ivano Legnini et al (2023): Spatiotemporal, optogenetic control of gene expression in organoids, in: Nature Methods, DOI: https://doi.org/10.1038/s41592-023-01986-w