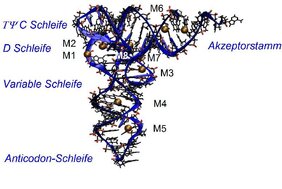
RNA-Strukturen bestehen aus langen Ketten von Nukleotiden, die sich aus einer Nukleobase, z.B. Adenin, Uracil, Cytosin oder Guanin, einer Phosphatgruppe und einem Zuckermolekül zusammensetzen. Die Phosphatgruppen weisen eine negative Ladung auf und bilden zusammen mit den Zuckereinheiten das Rückgrat des Makromoleküls, das in der Zelle als gefaltete sog. Tertiärstruktur vorliegt. Die durch Röntgenbeugung bestimmte Tertiärstruktur der tRNA von Hefe ist in Abbildung 1 gezeigt. Um diese Struktur in stabiler Form zu erhalten - eine Voraussetzung für ihre zelluläre Funktion - muss die abstoßende elektrische Kraft zwischen den negativ geladenen Phosphatgruppen durch positiv geladene Ionen und Wassermoleküle der Umgebung ausgeglichen werden. Wie das auf molekularer Ebene funktioniert, war bisher unverstanden, hinsichtlich der relevanten Anordnung von Ionen und Wassermolekülen bestehen Kontroversen in der wissenschaftlichen Literatur.
Forschern des Max-Born-Instituts ist es jetzt gelungen, Kontaktpaare von positiv geladenen Magnesium-Ionen mit den negativ geladenen Phosphatgruppen als entscheidendes Strukturelement der tRNA zu identifizieren, das die elektrostatische Energie minimiert und so die Tertiärstruktur der tRNA stabilisiert. Die in der Zeitschrift The Journal of Physical Chemistry B publizierte Studie verbindet spektroskopische Experimente mit eingehenden theoretischen Analysen der molekularen Wechselwirkungen und Dynamik.
Als Sonde für die Kopplung der tRNA mit ihrer Umgebung dienen molekulare Schwingungen der Phosphatgruppen, deren Frequenz und Infrarotabsorption durch die Wechselwirkung mit Ionen und Wassermolekülen direkt beeinflusst werden. Schwingungsspektroskopie an tRNA-Proben mit unterschiedlichem Magnesiumgehalt erlaubt in Kombination mit zweidimensionaler Infrarotspektroskopie im Femtosekunden-Zeitbereich die Unterscheidung spezifischer lokaler Umgebungen, in denen Phosphatgruppen und ihre Wasserhülle koppeln (Abb. 2). Die Anwesenheit eines Magnesium-Ions in direkter Nachbarschaft einer Phosphatgruppe erhöht die entsprechende Schwingungsfrequenz und führt zum Auftreten einer neuen charakteristischen Absorptionsbande.
Messungen mit unterschiedlicher Konzentration von Magnesium-Ionen zeigen, dass eine tRNA-Struktur bis zu sechs Kontaktionenpaare ausbildet, bevorzugt an Orten, an denen benachbarte Phosphatgruppen einen geringen Abstand aufweisen und somit eine hohe negative Ladungsdichte existiert. Die Kontaktionenpaare liefern den entscheidenden Beitrag zur Absenkung der elektrostatischen Energie und damit zur Stabilisierung der Tertiärstruktur, was durch die eingehende theoretische Analyse bestätigt wird. Die Ionenpaare üben elektrische Kräfte auf Wassermoleküle der unmittelbaren Umgebung aus und orientieren sie, eine zusätzliche Stabilisierung der Struktur. Hingegen tragen bewegliche Ionen, die sich in den ersten fünf bis sechs Wasserschichten um die tRNA befinden, nur in geringerem Maß zur Stabilisierung bei.
Die Ergebnisse geben einen detaillierten quantitativen Einblick in die elektrischen Eigenschaften eines biologischen Schlüsselmoleküls. Sie unterstreichen die Bedeutung molekularer Sonden für die Aufklärung der relevanten Wechselwirkungen und die Notwendigkeit theoretischer Beschreibungen auf molekularer Ebene.
Max-Born-Institut für Nichtlineare Optik und Kurzzeitspektroskopie (MBI)
Originalpublikation:
J. Schauss, A. Kundu, B. P. Fingerhut, T. Elsaesser: Magnesium contact ions stabilize the tertiary structure of transfer RNA: electrostatics mapped by two-dimensional infrared spectra and theoretical simulations. J. Phys. Chem. B (open access).