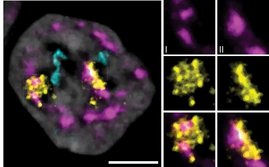
Enormes Potential für die Forschung und künftige Therapien bietet die Erzeugung von Hepatozyten (Leberzellen) aus pluripotenten Stammzellen. Doch bislang ist nicht hinreichend erforscht, welche Prozesse Stammzellen dazu bringen, wie echte Leberzellen zu funktionieren. Eine aktuelle Studie des Leibniz-Instituts für Arbeitsforschung in Dortmund (IfADo) zeigt nun: Das genregulatorische Netzwerk des DNA Transkriptionsfaktors CDX2 spielt eine entscheidende Rolle bei diesem Problem.
Darm und Leber: Zellen zeigen hybride Eigenschaften
In früheren Forschungsarbeiten hatte die Forschungsgruppe „Regulatorische Netzwerke der Stammzelldifferenzierung (StemNet)” unter der Leitung von Dr. Patrick Nell gezeigt, dass die derzeitigen Methoden zur Gewinnung von Hepatozyten aus Stammzellen zu sogenannten Hybridzellen führen – Zellen, die sowohl Eigenschaften von Leber- als auch von Darmzellen besitzen.
„Hepatozyten und Epithelzellen des Darmtraktes haben einen gemeinsamen Ursprung in der Embryonalentwicklung, da sich die Leber aus einem Teil des primitiven Darmtraktes entwickelt. In der späteren Entwicklung reifen die unterschiedlichen Zelltypen heran, was durch unterschiedliche Aktivitätsniveaus in den Gen-Netzwerken gesteuert wird, die mit den jeweiligen Zelltypen assoziiert sind”, erklärt Antonia Thomitzek, Doktorandin bei StemNet. „Unsere begrenzte Kontrolle über diesen Prozess führt zur Bildung von Hybridzellen, die die Funktion physiologischer Leberzellen noch nicht getreu widerspiegeln.“
Die StemNet-Forschungsgruppe hat nun entdeckt, dass das CDX2-Netzwerk, das während der Bildung von Leberzellen aus Stammzellen unerwartet aktiv ist, eine entscheidende Rolle bei der Entstehung des hybriden Phänotyps von aus Stammzellen gewonnenen Hepatozyten spielt. Durch das Ausschalten von CDX2 konnten sie die Entstehung unerwünschter Eigenschaften verhindern, die eher für Darmzellen als für Hepatozyten typisch sind.
Genschere ermöglicht funktionalere Leberzellen
In ihrer aktuellen Studie verwendeten die Forschenden das „Genschere“-System CRISPR-Cas9, um selektiv das CDX2-Gen auszuschalten. CRISPR-Cas9 ist eine molekularbiologische Methode zum Schneiden und Modifizieren von DNA an einer ausgewählten Stelle. Wird CDX2 mit dieser Methode ausgeschaltet, wird die Entwicklung von darmtypischen Eigenschaften fast vollständig verhindert. Stattdessen entwickeln die Zellen einen eindeutigen Leberphänotyp. Sie zeigen verbesserte Leberfunktionen wie die korrekte Bildung von Gallengängen und einen effizienteren Transport von Gallensäuren. Diese Eigenschaften sind für funktionelle Leberzellen essenziell.
„Das Verständnis der Einflüsse von Gen-Netzwerken auf die Entstehung der zellulären Identität ist grundlegend für die Entwicklung zuverlässiger Zell- und Gewebemodellsysteme auf Basis der Stammzelltechnologie“, erklärt Dr. Patrick Nell. „Auf diese Weise treiben wir die Forschung zu geeigneten Alternativen zu Tierversuchen und die verantwortungsvolle Entwicklung zukünftiger Zelltherapien voran.“
Die Ergebnisse sind Teil des Projekts „HyCell“, das von der Deutschen Forschungsgemeinschaft mit rund 408.000 Euro gefördert wird und bis 2028 läuft. Sie markieren einen Meilenstein in der Weiterentwicklung der Stammzelltechnologie, da repräsentativere In-vitro-Systeme für die Leberforschung die Arzneimittelentwicklung effizienter und sicherer machen und Anwendungen in der regenerativen Medizin zugutekommen könnten.
Leibniz-Institut für Arbeitsforschung an der TU Dortmund
Originalpublikation:
Nell P., Thomitzek A., Feuerborn D. et. al. 2025. Elimination of CDX2 restricts intestinal hybrid differentiation signatures in stem cell-derived hepatocyte like cells. Stem Cell Research & Therapy 543. https://doi.org/10.1186/s13287-025-04696-6