In den vergangenen Jahrzehnten erschienen Hunderte von Medikamenten-Wirkstoffen in Tierversuchen so vielversprechend, dass sie auch am Menschen in aufwändigen Studien, beispielsweise gegen die Alzheimer-Demenz, erprobt wurden. Aber: Nur einer kam durch und wurde letztlich zur Behandlung der Patienten zugelassen. Allein diese bescheidene Quote belegt, wie dringend die Medikamenten-Entwicklung experimentelle Modelle braucht, die auf menschlichen Zellen beruhen und Effekte und Risiken möglicher neuer Wirkstoffe besser abbildet. Zusätzlich sind auch Grundlagen-Wissenschaftler an Forschungseinrichtungen auf realistische Modelle angewiesen, um die genetischen und molekularen Grundlagen von Hirnerkrankungen wie Parkinson, Alzheimer oder Schlaganfall zu entschlüsseln.
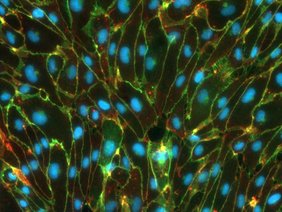
Eine der offenen Fragen ist zum Beispiel, welche Rolle Störungen der Blut-Hirn-Schranke bei neurologischen Erkrankungen spielen? Diese ist ein komplexes System mehrerer Zelltypen, vor allem Endothelzellen der innersten Schicht der Blutgefäßwände, aber auch glatten Muskel- und Gliazellen. Sie formen einerseits eine nahezu undurchdringbare passive Barriere und sorgen andererseits auch aktiv dafür, dass für das Gehirn wichtige Stoffe durchgelassen und potenziell gefährliche Stoffe aus dem Blut ausgeschlossen werden. „So schafft diese Schranke im Gehirn eine ganz bestimmte Umgebung, ohne die die Nervenzellen nicht reibungslos arbeiten könnten“, erklärt Prof. Dr. Dominik Paquet, Professor für Neurobiologie am Institut für Schlaganfall- und Demenzforschung (ISD) des LMU Klinikums München.
2018 begann sein Team, ein Modell der Blut-Hirn-Schranke im Labor nachzubauen. Grundlage dafür bilden sogenannte induzierte pluripotente Stammzellen (iPS) des Menschen. Aus ihnen haben die Experten des Instituts für Schlaganfall- und Demenzforschung (ISD) alle nötigen Zelltypen für eine Blut-Hirn-Schranke hergestellt. Mit einigen Tricks der Molekular- und Zellbiologie haben es die Forschenden dann geschafft, dass sich diese Zellen in einer gelartigen Matrix auch zu einem funktionierenden dreidimensionalen Gewebe formen, das auf den mikroskopischen Bildern den Blutgefäßen im Gehirn sehr ähnlich ist. „In enger Zusammenarbeit mit dem Labor von Martin Dichgans konnten wir auch zeigen, dass sich in diesem Modell Krankheitsprozesse erforschen lassen“, so Paquet weiter. „Beispielsweise haben wir herausgefunden, dass die Blut-Hirn-Schranke nicht mehr richtig funktioniert, wenn in den Endothelzellen ein sogenanntes Risiko-Gen verändert ist, welches häufig bei Patienten mit Schlaganfällen auftritt,“ sagt Prof. Dr. Martin Dichgans, Direktor des Instituts für Schlaganfall- und Demenzforschung (ISD).
Das experimentelle System steht jetzt den Wissenschaftlern weltweit zur Verfügung, wenn sie Forschungsfragen rund um die Blut-Hirn-Schranke beleuchten wollen. „Das System lässt sich in jedem Labor schnell innerhalb einiger Wochen etablieren“, sagt Paquet. Er hofft darauf, dass sich die Entwicklung neuer Therapien für neurologische Erkrankungen mit dem Modell aus München beschleunigen wird.
LMU Klinikum München
Originalpublikation:
González-Gallego, J., Todorov-Völgyi, K., Müller, S.A. et al. A fully iPS-cell-derived 3D model of the human blood–brain barrier for exploring neurovascular disease mechanisms and therapeutic interventions. Nat Neurosci (2025). doi.org/10.1038/s41593-025-02123-w