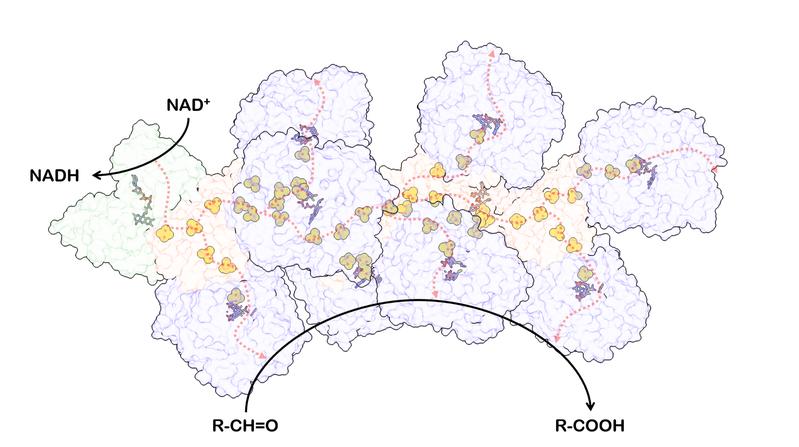
Das Team entdeckte, dass dieses Enzym ein Stromkabel durch die Zelle bildet. „Damit erhöht das Enzym sowohl seine Stabilität als auch seine Effizienz deutlich“, sagt Szaleniecs Mitarbeiterin Agnieszka Winiarska, eine weitere Leitautorin. „Das Enzym verwendet eine Kette von Elektronen-leitenden Cofaktoren in einer filamentösen Anordnung“, legt Schuller dar, der die Forschungsarbeit zusammen mit Heider leitete.
„Die meisten ähnlichen Metalloproteine dieser Familie weisen eine starke Sensibilität gegenüber Sauerstoff auf, was eine biotechnologische Anwendung stark erschwert. Dagegen zeigt AOR aus Aromatoleum aromaticum eine hohe Sauerstoffstabilität, die vermutlich durch seine außergewöhnliche molekulare Architektur begründet ist“, ergänzt Heider. Das Team berichtet im Wissenschaftsmagazin „Science Advances“ über seine Ergebnisse.
Aromatoleum aromaticum vermag organische Schadstoffe abzubauen und gilt somit als guter Kandidat für biotechnologische Anwendungen. „Wie viele andere Mikroorganismen erweitert dieser Stamm das Repertoire seines Stoffwechsels, indem er Übergangsmetalle in Enzyme einbaut, zum Beispiel Wolfram“, erläutert Schuller. Das gilt auch für das in dieser Studie untersuchte Enyzm der Aldehyd-Oxidoreduktase, kurz AOR. Dieses Wolfram-haltige Enyzm katalysiert die Elektronenabgabe von Aldehydverbindungen.
„AOR- Enzyme sind die einzigen bekannten Biokatalysatoren, die auch die thermodynamisch schwierige Umkehrreaktion bewerkstelligen, wenn geeignete Elektronenspender zur Verfügung stehen“, führt Fidel Ramírez-Amador aus. „Obwohl AOR-Enzyme so hochentwickelte Reaktionen durchführen können, ist unser Wissen über ihre Struktur und den Mechanismus ihrer Funktion bisher spärlich“, konstatiert Heider.
„Überraschenderweise fanden wir, dass sich mehrere Enzymuntereinheiten zu kurzen Filamenten aneinanderreihen“, berichtet Ramírez-Amador. Diese Untereinheit ähnelt dem eisen- und schwefelhaltigen Protein Ferredoxin, das beim Elektronentransport mitwirkt.
„Die entstehende Struktur gleicht somit einem elektronenleitenden Nanodraht“, sagt Schuller. „Der filamentöse Kern des Enzyms wird von den katalytischen Untereinheiten umhüllt wie ein Kupferkabel von einem Plastikmantel. Diese Architektur schirmt den Nanodraht ab und bietet gleichzeitig die Möglichkeit, den Komplex mit vielen Elektronen aufzuladen.“
Universität Marburg
Originalveröffentlichung:
Agnieszka Winiarska, Fidel Ramírez-Amador & al.: A bacterial tungsten-containing aldehyde oxidoreductase forms an enzymatic decorated protein nanowire, Science Advances 2023, DOI: http://www.science.org/doi/10.1126/sciadv.adg6689