Stickstoff-Dünger ist ökologisch problematisch
Das Element Stickstoff ist unverzichtbarer Bestandteil aller lebenden Organismen; in der Landwirtschaft wird es häufig als Dünger zugesetzt, um langfristige, hohe Erträge zu ermöglichen. Die Produktion und Anwendung dieser Düngemittel ist aber energetisch und ökologisch problematisch. Seit Jahren wird daher versucht, die natürliche Stickstofffixierung in Bakterien und Archaeen auf Nutzpflanzen zu übertragen. Die Bindung des Stickstoffs wird durch das Enzym Nitrogenase realisierte. Zu den gravierendsten Problemen bei der Übertragung auf Pflanzen zählt, dass die Nitrogenase extrem empfindlich gegenüber dem Sauerstoff in der Atmosphäre ist – der von den Pflanzen selbst im Prozess der Photosynthese produziert wird.
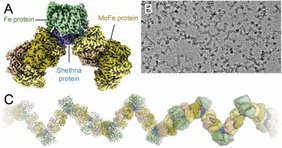
Shethna-Protein II bildet Komplex mit Enzym Nitrogenase
Philipp Franke, Simon Freiberger und Dr. Lin Zhang aus dem Team von Prof. Oliver Einsle konnten nun zeigen, wie ein kleiner Faktor, das Shethna-Protein II, einen Anstieg der Sauerstoffkonzentration registriert. Daraufhin bildet es sehr schnell einen Komplex mit den beiden Komponenten des Enzyms Nitrogenase, der diese vor oxidativer Schädigung schützt. Dabei bindet das Shethna-Protein II nach Aktivierung die viel größere Nitrogenase sowie ihre zugehörige Reduktase und bildet mit beiden Proteinen lange Filamente, in denen Sauerstoff die aktiven Zentren der Nitrogenase nicht erreichen kann. Sobald die Zellen diesen Sauerstoffstress überwinden, löst sich der Komplex auf und das Enzym kann seine Arbeit wieder aufnehmen.
Einsatz in Pflanzenzellen denkbar
Auch bei einer Produktion der Nitrogenase direkt in Pflanzenzellen ist damit zu rechnen, dass solche kurzen Stressphasen mit erhöhten Sauerstoffkonzentrationen immer wieder vorkommen. Bei einer biotechnologischen Nutzung könnte die Koproduktion des kleinen Shethna-Proteins II dann helfen, die aufwendig synthetisierten Enzyme auch in ihrer neuen Umgebung zu schützen und ihre Funktion für die Pflanzenzelle zu erhalten. „Die Produktion funktionierender Nitrogenase in Pflanzen würde einen Paradigmenwechsel der grünen Biotechnologie einleiten, und dieses kleine Protein kann einen entscheidenden Beitrag dazu liefern, dies möglich zu machen“, sagt Einsle.
Universität Freiburg
Originalpublikation:
Franke, P., Freiberger, S., Zhang, L., Einsle, O.: Conformational protection of molybdenum nitrogenase by Shethna protein II. In: Nature (2025).
DOI: https://doi.org/10.1038/s41586-024-08355-3