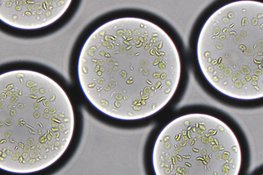
Über Milliarden von Jahren haben Mikroorganismen und Pflanzen die Fotosynthese entwickelt. Die Umwandlung von Sonnenenergie in chemische Energie versorgt alles Leben auf der Erde mit Nahrung und Sauerstoff. In höheren Pflanzen geschieht dies in zellulären Kompartimenten, den Chloroplasten. Der künstliche Nachbau der Fotosynthese gilt als eine Art "Apollo-Projekt“ unserer Zeit:Damit ließen sich Kohlenstoffverbindungen wie Antibiotika und andere Produkte nachhaltig aus Licht und Kohlendioxid herstellen.
Doch wie konstruiert man eine künstliche fotosynthetisch aktive Zelle? Der Schlüssel liegt darin, ihre wesentlichen Komponenten zum richtigen Zeitpunkt am richtigen Ort zusammenwirken zu lassen. Die Max-Planck-Gesellschaft verfolgt dieses Ziel im Rahmen des interdisziplinären Forschungsnetzwerks MaxSynBio. Nun ist es seinem Marburger Forscherteam um Direktor Tobias Erb gelungen, eine Plattform zum automatisierten Bau zellgroßer fotosynthetisch aktiver Kompartimente zu schaffen. Die damit erzeugten künstlichen Chloroplasten können das Treibhausgas Kohlendioxid mittels Licht einfangen und umwandeln.
Dazu vereinte das Max-Planck-Team zwei neue Technologien: die Synthetische Biologie für die Konstruktion neuartiger biochemischer Reaktionsnetzwerke und die Mikrofluidik, eine Nanotechnologie für das Erzeugen zellähnlicher Strukturen aus flüssigen Materialien. „Als allererstes benötigten wir ein Energiemodul, das es uns erlaubt, chemische Reaktionen nachhaltig zu betreiben. Bei der Fotosynthese liefern Chloroplasten-Membranen die Energie für die Kohlendioxid-Fixierung. Ihre Fähigkeiten wollten wir nutzen", erklärt Tobias Erb.
Der aus der Spinatpflanze isolierter Fotosynthese-Apparat zeigte sich robust genug, um im Reagenzglas Einzelreaktionen und komplexere Reaktionsnetzwerke mit Licht antreiben zu können. Für die Dunkelreaktion setzten die Forschenden den von ihnen selbst entwickelten CETCH-Zyklus ein. Dieses künstliche Stoffwechselmodul besteht aus 18 Biokatalysatoren, die Kohlendioxid effizienter umwandeln als der in Pflanzen natürlich entstandene Kohlenstoffmetabolismus. Nach mehreren Optimierungsrunden gelang dem Team in Marburg die lichtgesteuerte Fixierung des Treibhausgases Kohlendioxid in vitro.
Die zweite Herausforderung war der Zusammenbau des Systems innerhalb eines definierten Kompartiments im Mikromaßstab. Auch sollte die Produktion im Hinblick auf spätere Anwendungen einfach automatisierbar sein. In Zusammenarbeit mit dem Labor von Jean-Christophe Baret vom Centre de Recherché Paul Pascal (CRPP) in Frankreich entwickelte dasTeam in Marburg eine Plattform für die Einkapselung der semi-synthetischen Membranen in zellähnliche Tröpfchen.
Effizienter als natürliche Fotosynthese
Die entstandene Mikrofluidik-Plattform kann Tausende standardisierter Tröpfchen produzieren, die je nach den gewünschten Stoffwechselfähigkeiten individuell ausgestattet werden können. "Wir können eine Vielzahl identisch ausgestatteter Tröpfchen herstellen, oder einzelne mit spezifischen Eigenschaften versehen", sagt Tarryn Miller, Erstautorin der Studie. "Diese lassen sich zeitlich und räumlich mittels Licht steuern.“
Im Gegensatz zur traditionellen Gentechnik am lebenden Organismus bietet dieser Ansatz entscheidende Vorteile: Er konzentriert sich auf minimales Design und ist nicht notwendigerweise auf die Grenzen der natürlichen Biologie beschränkt. "Mit der Plattform können wir neuartige Lösungen umsetzen, die die Natur während der Evolution nicht beschritten hat", erklärt Tobias Erb. Nach seiner Einschätzung bergen die Ergebnisse viel Zukunftspotenzial. So konnten die Forschenden zeigen, dass der künstliche Chloroplast mithilfe der neuartigen Enzyme und Reaktionen Kohlendioxid 100-mal schneller bindet als bisherige synthetisch-biologische Ansätze. "Langfristig könnten lebensechte Systeme in praktisch allen technologischen Bereichen Anwendung finden, einschließlich Materialwissenschaften, Biotechnologie und Medizin.“ Die Ergebnisse sind auch ein weiterer Schritt zur Bewältigung einer der größten Herausforderungen der Zukunft: die der ständig steigenden Konzentrationen von atmosphärischem Kohlendioxid.
Max-Planck-Institut für terrestrische Mikrobiologie
Originalpublikation:
Miller, T.E.; Beneyton, T.; Schwander, T.; Diehl, C.; Girault, M.; McLEan, R.; Chotel, T.; Claus, P.; Socorro Cortina, N.; Baret, J.-C.; Erb, T.J.: Light-powered CO2 fixation in a chloroplast mimic with natural and synthetic parts, Science Vol. 368 (6491), 649