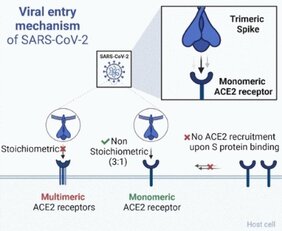
SARS-CoV-2-Viren tragen etwa 24 bis 40 von ihrer Oberfläche abstehende Spikes, die als Trimere aus drei gleichen Proteinen aufgebaut sind. Nach mehr als zwei Jahren Forschung ist es inzwischen unbestritten, dass der entscheidende erste Schritt bei einer Infektion die Bindung dieser Spikes an das Angiotensin konvertierende Enzym 2 (Angiotensin-Converting Enzyme 2, ACE2) ist. ACE2 kommt fast überall im Körper vor und ist an diversen physiologischen Funktionen beteiligt, z.B. der Regulation von Blutdruck und Kreislauf. Für die Viren fungiert ACE2 als Eintrittsrezeptor: Nach der Bindung wird das Viruspartikel von der Wirtszelle aufgenommen. Die bislang unbeantworteten Fragen: Binden die Spikes, die ja aus drei Untereinheiten bestehen, gleichzeitig an mehrere ACE2-Rezeptoren? Und wenn ja, liegt ACE2 bereits in Form von Dimeren oder Oligomeren in der Membran vor? Oder aggregieren mehrere ACE2 durch die Bindung der Spikes? Weder noch, sagt jetzt das Team um Gerti Beliu und Markus Sauer.
Das Team von der Universität Würzburg markierte die ACE2-Rezeptoren verschiedener Zelllinien, die als Infektionsmodelle für Corona gelten, durch unterschiedliche Methoden mit Fluoreszenzfarbstoffen und untersuchte sie mithilfe von dSTORM (stochastische optische Rekonstruktions-Mikroskopie). Dabei handelt es sich um ein Fluoreszenz-Bildgebungsverfahren mit extrem hoher Auflösung jenseits der Beugungsgrenze klassischer Verfahren. Auf diese Weise gelang es, die Menge und Verteilung der ACE2-Rezeptoren in der Plasmamembran zu ermitteln. Wie sich zeigte, liegen diese gleichmäßig verteilt in einer im Vergleich zu den meisten anderen Membranrezeptoren sehr geringen Dichte von etwa ein bis zwei ACE2-Molekülen pro Quadratmikrometer vor – als Monomere. Die Untersuchungen nach Zugabe der trimeren viralen Spikes zeigten eindeutig, dass die Bindung keine Bildung von ACE2-Oligomeren induziert.
Infektionsstudien unter Verwendung eines anderen Virustyps (Vesikulärer Stomatitis Virus, VSV), der ebenfalls Spikes trägt, unterstützen die Schlussfolgerung, dass eine einzelne Interaktion zwischen einem einzigen Spike-Protein pro Viruspartikel mit einem einzigen monomeren ACE2-Rezeptor für eine Infektion ausreicht – wohl mit ein Grund für die hohe Infektiosität von SARS-CoV-2.
Die neuen quantitativen molekularen Erkenntnisse zu den Wechselwirkungen zwischen Spike-Proteinen und ACE2 auf der Zellmembran könnten neue Perspektiven für die Entwicklung von verbesserten Wirkstoffen für die Behandlung von Corona-Infektionen eröffnen.
Gesellschaft Deutscher Chemiker e.V., Angewandte Chemie
Originalpublikation:
Eiring, P., Klein, T., Backes, S., Streit, M., Jungblut, M., Doose, S., Beliu, G., Sauer, M., Angew. Chem. Int. Ed. 2023, e202300821. https://doi.org/10.1002/anie.202300821