Der Zelltod ist für Lebewesen überlebenswichtig. Beschädigte oder mit Viren oder Bakterien infizierte Zellen eliminieren sich selbst. Sie begehen quasi Selbstmord und verhindern damit, dass Tumore entstehen oder die Erreger sich im Körper ausbreiten. Zu diesem Zweck starten die Zellen ein eingebautes Selbstmordprogramm.
Lange Zeit nahm man an, dass die Zellen an ihrem Lebensende einfach aufplatzen und sterben. Ein amerikanisches Wissenschaftlerteam hat diese These kürzlich widerlegt. Jetzt haben Forschende des Biozentrums, Universität Basel, der Universität Lausanne und des Departements Biosysteme (D-BSSE) der ETH Zürich die Details aufgeklärt. Im Fachjournal «Nature» beschreiben sie, wie der letzte Schritt beim Zelltod tatsächlich von statten geht.
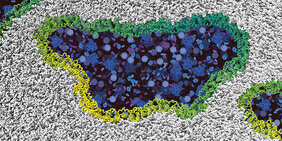
Ein Protein namens Ninjurin-1 reiht sich zu einer Kette aneinander, entlang der sich die Zellmembran wie ein Reissverschluss öffnet. Auf diese Weise zerstört sich die Zelle selbst. Die neuen Erkenntnisse sind ein wichtiger Meilenstein für das Verständnis des Zelltods.
Protein kreiert Sollbruchstellen in der Zellhülle
Unterschiedlichste Signale wie beispielsweise Bakterienbestandteile setzen die Selbstmordmaschinerie in der Zelle in Gang. Am Ende des Sterbeprozesses der Zelle wird die schützende Membran angegriffen. Sie bekommt winzige Löcher, durch die Flüssigkeit in die Zelle strömt.
«Die landläufige Meinung war, dass die Zelle langsam aufquillt und aufgrund des Überdrucks schliesslich platzt», erklärt Prof. Dr. Sebastian Hiller vom Biozentrum der Universität Basel. «Mit diesem Paradigma räumen wir nun auf. Die Zelle zerplatzt nicht einfach wie ein Ballon, vielmehr sorgt das Protein Ninjurin-1 für Sollbruchstellen. Genau an diesen Stellen bricht die Zellmembran auf und nicht zufällig irgendwo.»
Ninjurin-1 Proteine spalten Membran
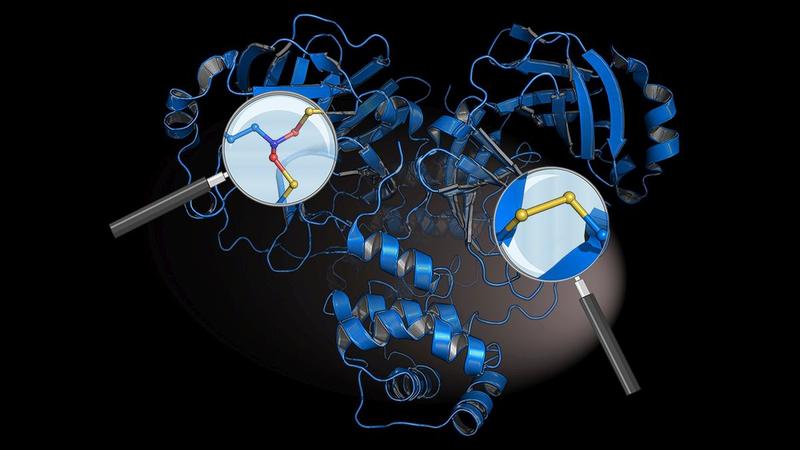
Mit hochempfindlichen Mikroskopen und der sogenannten NMR-Spektroskopie konnten die Wissenschaftler den Mechanismus bis auf die Ebene einzelner Atome aufklären. Ninjurin-1 ist eigentlich ein kleines Protein, welches in der Membran schwimmt.
«Nach Erhalt des Suizid-Befehls lagern sich zunächst zwei Ninjurin-1 Proteine zusammen und treiben einen Keil in die Membran», erklärt Morris Degen, Erstautor der Studie und PhD-Student der Doktorandenschule des Swiss Nanoscience Institute. «Grosse Risse und Löcher entstehen, indem sich viele weitere Proteine an den Ninjurin-1 Keil hängen. Die Zellmembran reisst so Stück für Stück auf, bis die Zelle komplett zerfällt.» Die Zelltrümmer beseitigt anschliessend der körpereigene Aufräumdienst.
«Wir wissen jetzt, dass die Zellen ohne Ninjurin-1 nicht platzen. Sie bläht sich durch den Flüssigkeitseinstrom zwar bis zu einem gewissen Mass auf, doch damit die Membran aufreisst, muss erst dieses Protein in Aktion treten», fügt Hiller hinzu. «Das Kapitel Zelltod wird in den Lehrbüchern nun um einen wichtigen Teil erweitert.»
Mit Therapien den Zelltod verhindern oder fördern
Je genauer man den Zelltod versteht, desto eher lassen sich geeignete Angriffspunkte für Medikamente finden. Denkbar wäre der Einsatz in der Krebstherapie, denn einige Tumorzellen schalten das Selbstmordprogramm einfach ab. Auch ein zu früher Zelltod, wie er bei neurodegenerativer Erkrankungen wie Parkinson auftritt oder ein lebensbedrohlicher septischer Schock bei Infektionen liesse sich mit Wirkstoffen, die in das Geschehen eingreifen, möglicherweise verhindern.
Universität Basel
Originalpublikation:
Degen, M., Santos, J.C., Pluhackova, K. et al. Structural basis of NINJ1-mediated plasma membrane rupture in cell death. Nature (2023). doi.org/10.1038/s41586-023-05991-z