Das Masernvirus und das Hundestaupevirus (Canine Distemper Virus, CDV) gehören zur Gattung Morbillivirus: bei diesen handelt es sich um hochansteckende RNA-Viren, die von einer Hülle umgeben sind, auf der ihre «Andock-Proteine» herausragen – ähnlich wie das Spike-Protein beim Coronavirus. Beide Viren verursachen sowohl Atemwegsinfektionen als auch tödliche Gehirnentzündungen, wobei Hirninfektionen nur bei CDV häufig vorkommen. Obwohl gegen Masern ein wirksamer Impfstoff zur Verfügung steht, sterben daran immer noch über 100‘000 Menschen pro Jahr. Das Hundestaupevirus seinerseits verursacht speziell bei Wildtieren grosse Epidemien, unter anderem auch bei bedrohten Tierarten wie bestimmte Tigerarten. Es besteht zudem ein hohes Risiko einer Übertragung auf andere Tierarten – in Ländern mit unzulänglichem Impfschutz können Hunde schwer befallen werden.
Aktuell kein antivirales Medikament zugelassen
Bei Masern könnten antivirale Medikamente eine gute Ergänzung zu den Impfkampagnen darstellen. Und auch bei CDV würden Medikamente die Behandlung von infizierten gefährdeten Arten in Gefangenschaft, zum Beispiel Pandas, unterstützen. Allerdings ist derzeit kein antivirales Morbillivirus-Medikament zugelassen. Um wirksame Medikamente herzustellen, ist ein besseres Verständnis der Struktur des Masern- und Staupevirus und der Mechanismen, die das Eindringen in die menschlichen und tierischen Zellen ermöglicht nötig. Forschenden um Dimitrios Fotiadis vom Institut für Biochemie und Molekulare Medizin (IBMM) der Medizinischen Fakultät der Universität Bern und Philippe Plattet von der Abteilung für Neurologische Wissenschaften der Vetsuisse-Fakultät der Universität Bern ist es nun gelungen, erstmals die Struktur des «Andock-Proteins» des Hundestaupe-Virus zu bestimmen und auf molekularer Ebene abzubilden. Diese Erkenntnisse ermöglichen es, «massgeschneiderte» Wirkstoffe gegen das «Andock-Protein» zu entwickeln, die das Eindringen des Virus in Wirtszellen verhindern. Die Studie wurde im Fachjournal Proceedings of the National Academy of Science USA publiziert.
Das «Andock-Protein» gezielt blockieren
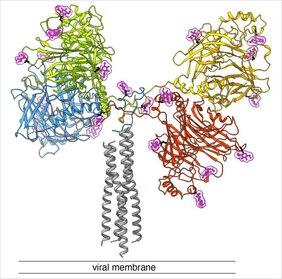
Der Mechanismus, mit dem sich die Masern- und das Hundestaupevirus in die Zellen einschleusen, basiert auf zwei Proteinen auf der Virushülle: einem «Andock-Protein» (auch H-Protein genannt) und einem «Fusionsprotein» (F-Protein). Aufgrund bisheriger Forschung geht man davon aus, dass das H-Protein bei der Interaktion mit einem Wirtszellrezeptor ein Signal übermittelt, welches das F-Protein aktiviert. Daraufhin kommt es zu einer Fusion der Virenhülle mit der Membran der Wirtszelle. Dabei wird eine sogenannte Fusionspore gebildet, die das Eindringen des viralen Erbguts in die Wirtszelle ermöglicht. Nun konnte das Team um Dimitrios Fotiadis und Philippe Plattet gemeinsam mit Forschenden der Zürcher Hochschule für Angewandte Wissenschaften (ZHAW) erstmals mittels Kryo-Elektronenmikroskopie (Kryo-EM) die Struktur dieses H-Proteins bestimmen und auf molekularer Ebene abbilden. Bei der Kryo-Elektronenmikroskopie werden biologische Proben bei kryogenen Temperaturen (rund −180 °C) und um 100’000-facher Vergrösserung abgebildet. Dabei zeigte sich, dass das Protein durch drei Hauptdomänen (Köpfe, Hals und Stiel) charakterisiert ist, die sich zu einem «Y» formen. «Dass wir die Struktur ermitteln konnten, stellt einen grossen Sprung nach vorn dar. Dies ermöglicht es uns nun zu verstehen, wie sich die verschiedenen Subdomänen räumlich zueinander verhalten – und liefert uns eine wertvolle Vorlage, um antivirale Medikamente der nächsten Generation zu entwickeln, die das ‹Andock-Protein› abblocken», sagt Dimitrios Fotiadis.
Neuartige therapeutische Ansätze
«Die gleichzeitige Blockierung des Zelleintrittprozesses beim Staupe- und Masernvirus mit mehreren unterschiedlichen neutralisierenden Molekülen ist eine vielversprechende antivirale Strategie», erklärt Philippe Plattet. Derzeit haben Forschende des Konsortiums um Plattet und Fotiadis und der Universität Marseille erfolgreich Antikörper identifiziert, die CDV auf hochwirksame Weise neutralisieren. Bei der weiteren Forschung wird die kürzlich neu eingerichtete
Kryo-EM-Plattform der Universität Bern nützliche Dienste leisten: so können die Strukturstudien für CDV und verwandte Viren jetzt erweitert und beschleunigt werden, etwa um die Strukturen der H-Proteine des Masern- und Staupevirus zu bestimmen, wenn sie an neutralisierende Antikörper gebunden sind. «Dank der durch Kryo-EM bestimmten viralen Strukturen können wir mittels sogenanntem Struktur-basiertem Wirkstoffdesign antivirale Medikamente entwickeln und verbessern», so Fotiadis.
Universität Bern
Originalpublikation:
David Kalbermatter, Jean-Marc Jeckelmann, Marianne Wyss, Neeta Shrestha, Dimanthi Pliatsika, Rainer Riedl, Thomas Lemmin, Philippe Plattet und Dimitrios Fotiadis: Struktur und supramolekulare Organisation des Canine Distemper Virus Attachment Glycoproteins. Proc. Natl. Acad. Sci. USA, 30. Januar 2023. https://doi.org/10.1073/pnas.2208866120