Bereits Ende März wurde das Projekt „Mutationsdynamik von SARS-CoV-2 in Österreich“ vom CeMM in enger Zusammenarbeit mit der Medizinischen Universität Wien ins Leben gerufen. Gemeinsam mit der Österreichischen Agentur für Gesundheit und Ernährungssicherheit (AGES) und in Kooperation mit zahlreichen Universitäten und Krankenhäusern in ganz Österreich arbeiten die WissenschaftlerInnen daran, durch Genomsequenzierung von SARS-CoV-2-Viren ein genaueres Bild der auftretenden Virusmutationen und Virusübertragungen zu zeichnen. Unter der Leitung der CeMM Principal Investigators Andreas Bergthaler und Christoph Bock wurden 750 Proben von wichtigen SARS-CoV-2-Infektionscluster in Österreich wie dem Tourismusort Ischgl und Wien phylogenetisch und epidemiologisch rekonstruiert und ihre Rolle bei der transkontinentalen Virusverbreitung analysiert. Die Ergebnisse liefern auch wesentliche Hinweise zur Übertragung und der Entstehung von Mutationen im SARS-CoV-2 Virus.
Mutationsanalysen deckten Zusammenhänge zwischen Clustern auf
Auf Basis der epidemiologische Daten konnten die WissenschaftlerInnen mithilfe von Mutationsanalysen einen SARS-CoV-2 Cluster bestehend aus 76 Fällen genau nachkonstruieren und einen Zusammenhang zwischen zwei epidemiologischen Clustern aufdecken, die bis dahin getrennt voneinander eingestuft worden waren. „Dieses konkrete Beispiel veranschaulicht, wie wichtig das Zusammenspiel von Contact Tracing und Mutationsanalyse eine starke Säule der modernen Pandemie-Bekämpfung sein können“, so Projektleiter Andreas Bergthaler. Dieser Einschätzung pflichtet auch Franz Allerberger, Leiter des Geschäftsfelds Öffentliche Gesundheit der AGES und Mitautor der Studie, bei: „Die modernen Techniken der Virusgenomsequenzierung stellen eine wesentliche Unterstützung für das Contact Tracing dar und liefern ein detailiertes Verständnis des Pandemiegeschehens.“
ForscherInnen beobachten Entstehung von neuen Mutationen
Eine Besonderheit der Studie ist, dass eine Transmissionskette von acht aufeinander folgenden Übertragungen analysiert werden konnte. „Die Transmissionskette startete mit einem Rückkehrer aus Italien. Binnen 24 Tagen verbreitete sich das SARS-CoV-2 Virus im Großraum Wien über öffentliche und soziale Veranstaltungen in geschlossenen Räumen“, so die CeMM-StudienautorInnen Alexandra Popa und Jakob-Wendelin Genger. Die genaue Aufschlüsselung der Transmissionskette ermöglichte den WissenschaftlerInnen, die Entstehung einer neuen Mutation von SARS-CoV-2 genau zu beobachten. Andreas Bergthaler erklärt: „Dieser im Detail rekonstruierte Infektionscluster erlaubte uns mitzuverfolgen, wie das SARS-CoV-2 Virus im Mensch mutierte und dann weitergegeben wurde.“ Darüber hinaus beobachteten die WissenschaftlerInnen das Mutationsverhalten des Virus während des Krankheitsverlaufs in 31 PatientInnen. Dies kann zukünftig helfen abzuschätzen, ob Behandlungen die Mutationseigenschaften des Virus beeinflussen.
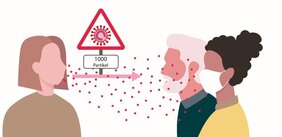
Durchschnittlich 1.000 Viruspartikel werden bei einer Infektion übertragen
Die Ergebnisse der aktuellen Analysen zeigen zudem, dass infizierte Personen durchschnittlich 1.000 infektiöse Viruspartikel aufgenommen hatten. Im Verhältnis zu HIV oder auch zu Noroviren deutet dies auf eine eher größere Virusmenge hin, die es für eine Infektion braucht. Dennoch können auch deutlich geringere Virusdosen eine Infektion auslösen. Andreas Bergthaler erklärt: „Vereinzelt fanden wir auch Infizierte, die offenbar mit deutlich weniger Viruspartikeln in Kontakt kamen und trotzdem infiziert wurden. Hier könnten andere Parameter wie die Anwendung von Schutzmaßnahmen, der Übertragungsweg oder auch das Immunsystem eine entscheidende Rolle spielen.“ Diese Ergebnisse werfen neue wichtige Fragen auf. Dazu zählt die Überlegung, dass die Verringerung der ausgestoßenen Virusladung von infizierten Personen durch kombinierte Maßnahmen wie Mund-Nasen-Schutz, physische Distanz und ausreichendem Luftaustausch in Innenräumen eine entscheidende Rolle in der Prävention der Virusverbreitung tragen und möglicherweise auch den Krankheitsverlauf beeinflussen kann.
Diese aktuelle Studie liefert wichtige Erkenntnisse über das frühe Pandemiegeschehen, wie das SARS-CoV-2 Virus mutiert und von Mensch zu Mensch übertragen wird. Diese Resultate stützen weitere schon laufende Forschungsprojekte mit dem Ziel, die Pandemie besser zu verstehen und zu kontrollieren.
CeMM
Originalpublikation:
Alexandra Popa et al.: „Genomic epidemiology of superspreading events reveals mutational dynamics and transmission properties of SARS-CoV-2” erschien in der Zeitschrift Science Translational Medicine am 23. November 2020. DOI: 10.1126/scitranslmed.abe2555
https://stm.sciencemag.org/content/early/2020/11/20/scitranslmed.abe2555.full
Zur Projektwebsite: http://www.sarscov2-austria.org