Wie aus unbelebter Materie Organismen entstehen, gehört zu den ganz großen Fragen der Wissenschaft. Zwar gibt es dafür viele Erklärungsansätze, aber keine endgültigen Antworten. Das ist kein Wunder: Diese Vorgänge haben sich vor drei bis vier Milliarden Jahren abgespielt, als auf der Erde völlig andere Bedingungen als heute herrschten.
Hypothesen mit experimentellen Daten begründen
«In diesem riesigen Zeitraum hat die Evolution die Spuren, die zu den Ursprüngen des Lebens zurückführen, gründlich verwischt», sagt Roland Riek, Professor für physikalische Chemie und Mitglied des Leitungsteams des neuen interdisziplinären «Centre for Origin and Prevalence of Life» an der ETH Zürich. Der Wissenschaft bleibt nichts anderes übrig, als Hypothesen aufzustellen – und diese so gut wie möglich mit experimentellen Daten zu begründen.
Riek und sein Team verfolgen schon seit Jahren die Idee, dass proteinähnliche Aggregate – sogenannte Amyloide – eine wichtige Rolle am Übergang zwischen Chemie und Biologie gespielt haben könnten. Zuerst hatte Rieks Forschungsgruppe nachgewiesen, dass solche Amyloide unter den Bedingungen, wie sie auf der frühen Erde geherrscht haben dürften, relativ einfach entstehen können: Im Labor braucht es nur etwas Vulkangas (sowie experimentelles Geschick und viel Geduld), damit sich einfache Aminosäuren zu kurzen Peptidketten verbinden, die sich daraufhin spontan zu Fasern aneinanderlagern.
Vorläufermoleküle des Lebens
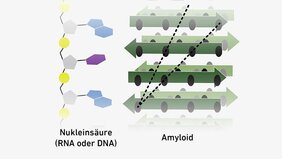
Später legte das Team um Riek dar, dass sich Amyloide selber vervielfältigen können – womit die Moleküle ein weiteres entscheidendes Kriterium erfüllen, um als Vorläufermoleküle des Lebens zu gelten. Und nun hauen die Forschenden mit einer aktuellen Studie ein drittes Mal in die gleiche Kerbe: Sie zeigen, dass Amyloide in der Lage sind, die Erbgutmoleküle RNA und DNA an sich zu binden.
Diese Wechselwirkungen beruhen zum Teil auf elektrostatischer Anziehung, denn einige Amyloide sind – zumindest stellenweise – positiv geladen, während die Erbsubstanz negativ geladen ist, jedenfalls in einer neutralen bis leicht sauren Umgebung. Doch Riek und sein Team haben zudem bemerkt, dass die Wechselwirkungen auch von der Abfolge der RNA- und DNA-Bausteine in der Erbsubstanz abhängen. Und also eine Art Vorstufe darstellen könnten für den universellen genetischen Code, der alle Lebewesen miteinander vereint.
Erhöhte Stabilität als großer Vorteil
Allerdings: «Wir sehen zwar Unterschiede in der Bindung der RNA- und DNA-Moleküle an die Amyloide, verstehen aber noch nicht, was diese Unterschiede bedeuten», sagt Riek. «Unser Modell ist wahrscheinlich noch zu einfach.» Für ihn sind die Resultate deshalb vor allem aus einem weiteren Grund von Bedeutung: Wenn sich die Erbsubstanz an Amyloide heftet, gewinnen beide Moleküle gegenseitig an Stabilität. In grauer Vorzeit dürfte sich die erhöhte Stabilität als großer Vorteil erwiesen haben.
Denn in der sogenannten Ursuppe damals waren biochemische Moleküle sehr stark verdünnt. Im Vergleich dazu sind diese Moleküle in heutigen biologischen Zellen dicht aufeinander gepackt. «Amyloide haben erwiesenermaßen das Potenzial, die lokale Konzentration und die Ordnung von RNA- und DNA-Bausteinen in einem ansonsten verdünnten, ungeordneten System zu erhöhen», schreiben die Forschenden um Riek in ihrem kürzlich veröffentlichten Fachartikel.
Im Gespräch weist der ETH-Professor darauf hin, dass bei Darwins Evolutionstheorie zwar der Konkurrenzkampf im Zentrum steht, in der Evolution jedoch auch die Kooperation einen großen Stellenwert hatte. Von der stabilisierenden Wechselwirkung zwischen Amyloiden und RNA- oder DNA-Molekülen profitieren beide Molekülklassen, weil sich langlebige Moleküle über die Zeit stärker anreichern als unbeständige Substanzen. So dürfte bei der Entstehung des Lebens vielleicht sogar vielmehr die molekulare Kooperation als die Konkurrenz ausschlaggebend gewesen sein. «Denn Platz und auch Ressourcen gab es damals wohl mehr als genug», sagt Riek.
ETH Zürich
Originalpublikation:
Rout SK, Cadalbert R, Schröder N, Wang J, Zehnder J, Gampp O, Wiegand T, Güntert P, Klingler D, Kreutz C, Knörlein A, Hall J, Greenwald J, and Riek R. An Analysis of Nucleotide-Amyloid Interactions Reveals Selective Binding to Codon-Sized RNA. Journal of the American Chemical Society 2023, 145: 21915, doi: 10.1021/jacs.3c06287, pubs.acs.org/doi/10.1021/jacs.3c06287