Was passiert, wenn bestimmte Enzyme blockiert werden, haben Forscherinnen der Universität Göttingen an Mäusen untersucht. Je nachdem, ob das Gehirn gesund oder krank ist, hatte die Blockade gegenteilige Wirkungen. Die Ergebnisse sind in der Fachzeitschrift The Journal of Neuroscience erschienen.
Damit ein Lebewesen lernen kann, muss sein Gehirn plastisch sein. Das heißt, die Nervennetzwerke müssen sich verändern können. Wichtig hierfür sind Makromoleküle der extrazellulären Matrix, die sich zwischen den Nervenzellen befinden. Im Laufe des Lebens nimmt die „Festigkeit“ dieser extrazellulären Matrix zu, wodurch vermutlich die bestehenden Verbindungen zwischen den Nervenzellen stabilisiert werden und Erlerntes verfestigt wird. Wird nun eine neue Erfahrung gemacht, muss die extrazelluläre Matrix wieder gelockert werden, damit neue Verknüpfungen entstehen können. Dieses Verhältnis von Stabilität und Plastizität im Gehirn wird in der Matrix mithilfe von Enzymen wie beispielsweise Matrixmetalloproteinasen (MMPs) geregelt, die die extrazelluläre Matrix aufspalten und damit „lockern“ können. Ein Team der Universität Göttingen konnte jetzt in einer neuen Studie zeigen, dass die Blockade der Matrixmetalloproteinasen MMP2 und MMP9 unterschiedliche Effekte haben kann, je nachdem, ob das Gehirn krank oder gesund ist.
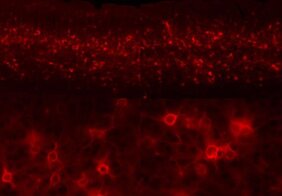
Um die neuronale Plastizität zu messen, ließen die Wissenschaftlerinnen erwachsene Mäuse für mehrere Tage nur über ein Auge sehen und registrierten die daraus resultierenden Aktivitätsänderungen in der Sehrinde der Tiere. In einem ersten Experiment untersuchten sie die Anpassungsfähigkeit der Sehrinde gesunder Mäuse, bei denen die Enzyme MMP2 und MMP9 blockiert wurden (mit SB3CT). In der Folge war auch die neuronale Plastizität blockiert. In einem zweiten Experiment forschte das Team an Mäusen unmittelbar nach einem Schlaganfall. Es war bereits bekannt, dass Schlaganfälle kurzfristig zu einem starken Anstieg der MMPs führen. Und hier erzeugte die gezielte, kurzfristige Blockade der Enzyme MMP2 und MMP9 einen gegenteiligen Effekt: Die durch den Schlaganfall stark reduzierte Plastizität wurde wiederhergestellt, die Blockade der Enzyme MMP2 und MMP9 hatte somit eine klare therapeutische Wirkung.
„Anders als in vielen anderen Studien wurden bei unserem Studienaufbau die ,matrixabbauenden‘ Enzyme erst nach dem experimentellen Schlaganfall blockiert, wodurch eine Behandlung simuliert wurde“, sagt Prof. Dr. Siegrid Löwel von der Abteilung für Systemische Neurobiologie der Universität Göttingen. „Wir zeigen zudem, dass die MMPs im Gehirn sehr gut überwacht und exakt eingestellt werden müssen. Ein zu geringes Level im gesunden Gehirn verhindert neuronale Plastizität und ein zu hohes Level – wie nach einem Schlaganfall – blockiert ebenfalls die neuronale Plastizität.“
Georg-August-Universität Göttingen
Originalpublikation:
Ipek Akol, Evgenia Kalogeraki, Justyna Pielecka-Fortuna, Merle Fricke and Siegrid Löwel. MMP2 and MMP9 Activity is Crucial for Adult Visual Cortex Plasticity in Healthy and Stroke-affected Mice. The Journal of Neuroscience (2022) 42(1):16–32; 11 November 2021, JN-RM-0902-21; DOI: https://doi.org/10.1523/JNEUROSCI.0902-21.2021