In der Zellbiologie und medizinischen Forschung werden leistungsstarke bildgebende Verfahren eingesetzt, um biologische Vorgänge in Zellen zu beobachten und zu analysieren. Dabei ist die gezielte Manipulation von Zellen unter kontrollierten Bedingungen eine große Herausforderung, um Prozesse und kausale Zusammenhänge zu verstehen. Die Forscher sind daher auf effektive Werkzeuge angewiesen, die es Ihnen ermöglichen einzelne Bestandteile einer Zelle zu manipulieren um deren Auswirkungen auf intrazelluläre Mechanismen und Wechselwirkungen zu erforschen.
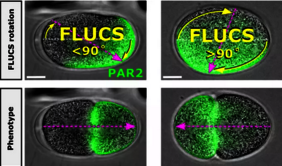
Ein häufiges Problem herkömmlicher Methoden der Zellmanipulation ist jedoch, dass die Probe durch die Manipulation gestört wird und so Ergebnisse verfälscht werden. Das neue FLUCS-Verfahren erlaubt nun erstmals eine nicht-invasive Manipulation von Zellen, beispielsweise in der Entwicklungsbiologie. FLUCS ist eine Methode der Photomanipulation, die es ermöglicht, Bewegungen innerhalb von Zellen und Embryonen mit Hilfe von Laserstrahlen gezielt zu beeinflussen und zu steuern. Durch den Strahl wird punktuell ein thermisches Feld im Zytoplasma induziert. Dieses verändert lokal eng begrenzt die Dichte und Viskosität des flüssigen Mediums und führt durch den schnell bewegten Laserpunkt zu einer Strömung. Im Gegensatz zu herkömmlichen Methoden, wie z.B. der optischen Pinzette, werden die Im Zytoplasma schwimmenden Biomoleküle direkt in Bewegung versetzt, ohne dass es einer Modifikation der Probe bedarf. Auch können diese nach wie vor ungehindert mit ihrer Umgebung interagieren. Die Methode kann insbesondere dazu genutzt werden, wichtige Fragen zur embryonalen Entwicklung zu klären.
So konnte ein Forscherteam um Moritz Kreysing vom Max-Planck-Institut (inzwischen am Karlsruher Institut für Technologie) kontrollierte Ströme in lebenden Wurm-Embryonen erzeugen und Biomoleküle an verschiedene Stellen des wachsenden Embryos transportieren. Durch die gezielte Umverteilung gelang es ihnen die Bedeutung der Bewegung des Zytoplasmas für die Polarisation von Eizellen, und damit die Frage, welches Molekül während der Entwicklung wann genau wohin muss, genauer zu untersuchen.
Marktreifes Produkt
Im Rahmen einer Entwicklungskooperation wurde die FLUCS-Technologie vom Max-Planck-Institut an die Firma Rapp OptoElectronic transferiert. Auf Basis der erfolgreichen gemeinsamen Entwicklung und dem nun abgeschlossenen Lizenzvertrag bietet Rapp OptoElectronic FLUCS als marktreifes Produkt Forscherinnen und Industrieanwendern weltweit an. Ein Pilotsystem befindet sich in der LMF (Light Microscopy Facility) des Max-Planck-Instituts für molekulare Zellbiologie und Genetik in Dresden. Hier steht FLUCS interessierten Wissenschaftlern von innerhalb und außerhalb der Max-Planck-Gesellschaft für ihre Forschungen zur Verfügung. Das Gerät wird als ein Zusatzmodul an hochauflösende Mikroskope über Standard-Schnittstellen eingebunden und kann so ohne großen Aufwand zur Photomanipulation genutzt werden.
„FLUCS schließt eine Lücke in den bisher verfügbaren Mikro-Manipulationstechniken um die Ursachen und Folgen der intrazellulären Bewegung zu untersuchen. Durch moderates Erwärmen der Probe mit einem Laserspot werden gerichtete Flüssigkeitsströmungen induziert. Dabei kann deren Pfad über die benutzerfreundliche Software einfach individuell vorgegeben werden, beispielsweise als Linie, Kreis oder Freiform. So lassen sich Bestandteile einer Zelle wie Organellen, PAR-Proteine und sogar Chromatin im Zellkern frei bewegen, ohne diese hierfür festhalten oder fixieren zu müssen“, so Sven Warnck, Geschäftsführer von Rapp OptoElectronic.
Vielfältige Anwendungsmöglichkeiten
Die Anwendungsmöglichkeiten sind dabei vielfältig. In der Zellbiologie können künstlich erzeugte zytoplasmatische Strömungen genutzt werden, um z.B. PAR-Proteine zu invertieren und so Einfluss auf die embryonale Entwicklung zu nehmen. In der medizinischen Forschung können z.B. molekulare Mechanismen und Signalwege in Zellen besser erforscht und die Entwicklung von Medikamenten unterstützt werden. In der Mikrofluidik kann mit Hilfe von FLUCS das Verhalten von Flüssigkeitsmengen im Mikro- oder Pikoliterbereich eingehender untersucht werden und so neue Methoden der Labormesstechnik, Qualitätskontrolle oder Lebensmittelsicherheit unterstützen.
„Wir freuen uns, dass durch die erfolgreiche Kooperation zwischen dem Max-Planck-Institut für molekulare Zellbiologie und Genetik und Rapp OptoElectronic erstklassige kommerzielle Produkte auf den Markt kommen werden, die dem aktuellen Stand der Technik weit überlegen sind. Durch FLUCS wird die Mikroskopie interaktiv und eröffnet neue Möglichkeiten für eine Vielzahl von Forschungsbereichen“, so Bernd Ctortecka, Patent- und Lizenzmanager bei Max-Planck-Innovation, der Technologietransfer-Organisation der Max-Planck-Gesellschaft.
Max-Planck-Gesellschaft