Forschende des Centre for Genomic Regulation (CRG) in Barcelona und des Max Delbrück Centers in Berlin haben untersucht, wie Zellen ihr Schicksal beschleunigen können. Ihre Ergebnisse stellen sie in der Fachzeitschrift „eLife“ vor. Die Studie könnte der Grundstein für neue Methoden sein, mit denen die molekularen Mechanismen der Krebsentstehung beeinflusst werden können.
Fresszellen von der Leine lassen
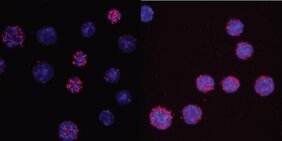
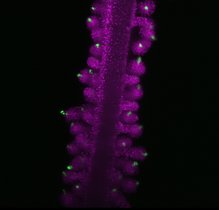
Im Mittelpunkt der Studie steht C/EBPα (CCAAT/enhancer-binding protein alpha), ein Protein, das die Umwandlung von B-Lymphozyten in Makrophagen steuert. B-Lymphozyten sind weiße Blutkörperchen, die Antikörper gegen Krankheitserreger bilden. Makrophagen, auch „Fresszellen“ genannt, gehören ebenfalls zu den weißen Blutkörperchen. Ihre Funktion ist das Finden und Beseitigen von Erregern und krankhaft veränderten Zellen. C/EBPα ist ein Transkriptionsfaktor, der an spezifische DNA-Sequenzen in den regulatorischen Regionen von Genen bindet. Dort aktiviert oder unterdrückt C/EBPα die Genexpression.
Wie alle Proteine besteht C/EBPα aus verschiedenen Aminosäuren. Bestimmte Enzyme können Proteine modifizieren, indem sie beispielsweise Methylgruppen – das sind kleine „Aufkleber“ aus je einem Kohlenstoffatom und drei Wasserstoffatomen – an bestimmte Aminosäuren anheften. Dieser Vorgang heißt Methylierung. Auf diese Weise können die Protein-Protein-Interaktionen mit C/EBPα wesentlich beeinflusst werden. Die Forschenden fanden heraus, dass ein bestimmter Aminosäure-Rest von C/EBPα, wenn er nicht methyliert ist, die Umwandlung von B-Lymphozyten zu Makrophagen stark beschleunigt. Die Methylierung dieses spezifischen Aminosäure-Rests wird durch das Enzym Carm1 vermittelt. Aus früheren Forschungen ist bekannt, dass Mäuse, denen Carm1 fehlt, resistent gegen einige Formen der akuten myeloischen Leukämie sind. Dies könnte an den Mechanismen liegen, die die Wissenschaftler*innen in der vorliegenden Studie aufgedeckt haben: Die unmethylierte Version von C/EBPα triggert die Makrophagendifferenzierung stärker als ihr methyliertes Gegenstück. Da Makrophagen ein sich selten teilender Zelltyp sind, könnte dies die Bildung von Krebszellen verhindern.
Neue Ideen für die Behandlung von Leukämien
„Indem wir verstehen, wie die Umwandlung des Zellschicksals beschleunigt oder gesteuert werden kann, entdecken wir neue Hinweise für die Krebsforschung“, sagt Letztautor Dr. Thomas Graf, Arbeitsgruppenleiter am CRG. „Wenn wir zum Beispiel auf das Gleichgewicht zwischen methylierten und unmethylierten Formen von C/EBPα abzielen, kann uns das helfen zu verstehen, wie sich Immunzellen differenzieren, und schließlich zu neuen Ideen für die Behandlung bestimmter Formen von Leukämie führen.“
Die Forschenden fanden die Position der kritischen Aminosäure in C/EBPα, als sie eine mutierte Form des Proteins namens C/EBPαR35A testeten. Diese Mutante beschleunigt die Umwandlung der B-Zellen in Makrophagen drastisch. Um eine Zellumwandlung einzuleiten, interagiert C/EBPα mit einem anderen Transkriptionsfaktor namens PU.1. Es zeigte sich, dass C/EBPαR35A viel stärker mit PU.1 interagiert als methyliertes C/EBPα. Das brachte die Gene der B-Zellen schneller zum Schweigen und aktivierte stattdessen die Gene der Makrophagen.
Medikamente gegen „verwirrte“ Zellen
Die Methylierung von C/EBPα ist ein Beispiel für einen epigenetischen Mechanismus. Diese Mechanismen steuern, wie das Genom – die Gebrauchsanweisung im Inneren jeder Zelle des menschlichen Körpers – gelesen wird. „Medikamente, die epigenetische Mechanismen beeinflussen, könnten tatsächlich die Funktion von Transkriptionsfaktoren verändern und Zellen korrigieren, die in die Irre gegangen sind, wie es bei Krebs und Leukämie der Fall ist“, sagt Co-Letztautor Professor Achim Leutz, Leiter der Arbeitsgruppe „Zelldifferenzierung und Tumorigenese“ am Max Delbrück Center. „In diesem neuartigen Mechanismus wird PU.1 durch C/EBPα stärker angelockt, um von einem B-Zell-Regulator zu einem Makrophagen-Regulator zu wechseln. Dies ist ein eleganter 'On-Off'-Mechanismus, der die Bildung eines reifen Zelltyps sicherstellt und die Bildung von ‚verwirrten‘ Zellen vermeidet, die häufig bei Blutkrebs auftreten. Wir könnten nun nach Medikamenten suchen, die auf diesen Mechanismus abzielen, um solche Defekte zu korrigieren.“
Bislang ist nicht viel darüber bekannt, was die Geschwindigkeit der Entscheidungsprozesse des Zellschicksals bestimmt. Die Studie legt nahe, dass solche Prozesse zum Beispiel Stammzellen nacheinander in die vielen verschiedenen Zelltypen im Körper umwandeln. Wenn man besser versteht, wie Zellen ihre Identität ändern und wie man diesen Prozess manipulieren kann, könnte man dies in der regenerativen Medizin nutzen oder Medikamente entwickeln, die besser gegen Krebs wirken.
Centre for Genomic Regulation (CRG) und Max Delbrück Center
Originalpublikation:
Guillem Torcal Garcia et al (2023): Carm1-arginine methylation of the transcription factor C/EBPα regulates transdifferentiation velocity, in: eLIFE, DOI: 10.7554/eLife.83951, elifesciences.org/articles/83951