Es ist nur eine winzige Veränderung im Genom, die dennoch fatale Effekte hat: Muskeldystrophien werden fast immer durch ein einzelnes fehlerhaftes Gen ausgelöst. So unterschiedlich die Mutationen bei den rund fünfzig bekannten Formen dieser Erkrankungen sind, führen sie letztendlich alle zu einem sehr ähnlichen Ergebnis. „Aufgrund des Genfehlers verändern sich der Aufbau und die Funktion der Muskeln, so dass die Erkrankten einen fortschreitenden Muskelschwund erleiden“, erläutert Professorin Simone Spuler, die Leiterin der Arbeitsgruppe Myologie am Experimental and Clinical Research Center (ECRC), einer gemeinsamen Einrichtung des Berliner Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und der Charité – Universitätsmedizin Berlin. Ist beispielsweise die Atem- oder Herzmuskulatur betroffen, kann die Krankheit tödlich enden.
Bei Mäusen hat sich die Methode schon bewährt
Heilbar sind Muskeldystrophien bislang nicht. Genau das versuchen Spuler und ihr Team jedoch zu ändern. Ihre jüngste Publikation, die in der Fachzeitschrift „Molecular Therapy Nucleic Acids“ erschienen ist, macht den Weg frei für eine Studie, bei der eine am ECRC entwickelte Therapie erstmals an Patientinnen und Patienten mit erblichem Muskelschwund getestet werden soll. „Wir verfolgen schon seit Jahren die Idee, erkrankten Menschen Muskelstammzellen zu entnehmen, die veränderten Gene mithilfe der Genschere CRISPR/Cas9 zu reparieren und die so behandelten Zellen zurück in die Muskeln zu injizieren, damit sie sich dort vermehren und neues Muskelgewebe bilden“, erläutert Dr. Helena Escobar, Postdoktorandin in Spulers Arbeitsgruppe und gemeinsam mit ihr Letztautorin der aktuellen Arbeit.
Vor einiger Zeit konnten die Forscher*innen bereits zeigen, dass das Verfahren bei Mäusen, die an Muskelschwund leiden, funktioniert. „Unsere Methode hatte bisher allerdings einen Haken“, sagt Escobar: „Wir haben die Bauanleitung für die Genschere mithilfe von Plasmiden – das sind ringförmige, doppelsträngige DNA-Moleküle aus Bakterien – in die Stammzellen eingeführt.“ Plasmide könnten sich aber ungewollt in das ebenfalls doppelsträngige Genom der menschlichen Zellen integrieren und dann zu unerwünschten, wenig abschätzbaren Effekten führen. „Patientinnen und Patienten hätten wir so daher nicht behandeln können“, sagt Escobar.
Gendefekte werden gezielt korrigiert
Das Team machte sich daher auf die Suche nach einer besseren Alternative: Gefunden hat es sie in Form von mRNA, jenen einsträngigen Erbgutmolekülen, die zuletzt vor allem als wesentlicher Bestandteil zweier Corona-Impfstoffe von sich reden gemacht haben. „In den Impfstoffen enthalten die mRNA-Moleküle die genetische Information für den Aufbau des Spike-Proteins des Virus, mit dem der Erreger in menschliche Zellen eindringt“, erläutert Christian Stadelmann, Doktorand in Spulers Arbeitsgruppe. Neben Silvia Di Francescantonio aus dem gleichen Team ist er einer der beiden Erstautor*innen der Studie. „Für unsere Zwecke nutzen wir mRNA-Moleküle, die die Bauanleitung für die Genschere enthalten.“
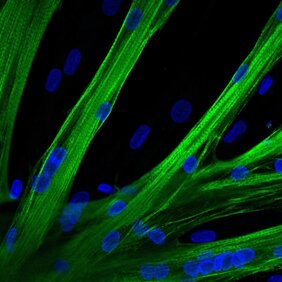
Um die mRNA in die Stammzellen hineinzuschleusen, wendeten die Forscher*innen ein Verfahren namens Elektroporation an, bei dem die Zellmembranen vorübergehend für größere Moleküle durchlässig werden. „Mithilfe von mRNA, die die genetische Information für einen grün fluoreszierenden Farbstoff enthielt, konnten wir zunächst nachweisen, dass fast alle Stammzellen die mRNA-Moleküle in sich aufnehmen“, berichtet Stadelmann. In einem nächsten Schritt zeigte das Team über ein absichtlich verändertes Molekül auf der Oberfläche menschlicher Muskelstammzellen, dass es mithilfe der Methode gelingen kann, Gendefekte gezielt zu reparieren.
Eine klinische Studie ist bereits geplant
Schließlich probierte das Team noch ein der Genschere CRISPR/Cas9 ähnliches Werkzeug aus, das die DNA aber nicht zerschneidet, sondern nur an einer Stelle punktgenau verändert. „Wir können damit noch feiner arbeiten. Allerdings ist dieses Tool nicht für jede Mutation geeignet, die eine Muskeldystrophie hervorruft“, erklärt Stadelmann. Mit Experimenten in der Petrischale konnten er und sein Team nun zeigen, dass die reparierten Muskelstammzellen ebenso wie gesunde Zellen in der Lage sind, miteinander zu fusionieren und junge Muskelfasern zu bilden.
„Wir planen jetzt, gegen Ende des Jahres eine erste klinische Studie mit fünf bis sieben Patientinnen und Patienten zu starten, die an Muskeldystrophie leiden“, kündigt Spuler an. Das zuständige Paul-Ehrlich-Institut habe die Idee beratend unterstützt. Natürlich könne man keine Wunder erwarten, sagt die Forscherin. „Erkrankte, die im Rollstuhl sitzen, werden auch nach unserer Therapie nicht einfach aufstehen und loslaufen.“ Doch für viele der Betroffenen sei es schon ein großer Fortschritt, wenn ein kleiner Muskel, der beispielsweise fürs Greifen oder Schlucken wichtig sei, wieder besser funktioniere. Die Idee, auch größere Muskeln, wie sie zum Stehen und Gehen benötigt werden, zu reparieren, stehe bereits im Raum, sagt Spuler. Dazu müssten die molekularen Werkzeuge allerdings so sicher werden, dass man sie bedenkenlos nicht nur in isolierte Muskelstammzellen, sondern direkt in den degenerierten Muskel einbringen könnte.
Max-Delbrück-Centrum für Molekulare Medizin
Originalpublikation:
Christian Stadelmann, Silvia Di Francescantonio et al. (2022): „mRNA-mediated delivery of gene editing tools to human primary muscle stem cells“. In: Molecular Therapy Nucleic Acids, DOI: 10.1016/j.omtn.2022.02.016