Serotonin ist ein wichtiger Botenstoff im zentralen Nervensystem. Er gehört zur Kategorie der sogenannten Neuromodulatoren und ist für die Informationsübertragung zwischen Nervenzellen im Gehirn und dem gesamten Körper zuständig. Insbesondere die Annahme, Angstzustände und Depressionen würden durch einen Serotoninmangel im Gehirn ausgelöst, rücken den Botenstoff regelmäßig in den Fokus der Wissenschaft. Kausale Zusammenhänge zwischen psychiatrischen Erkrankungen und Serotoninmangel konnten allerdings bisher nicht hinreichend beschrieben werden. Geeignete Methoden fehlten bislang.
Signalaustausch zwischen Nervenzellen besser verstehen
„Verschiedene genetisch kodierte Sensoren wurden in den vergangenen Jahren entwickelt, um die Freisetzung von Neurotransmittern genauer beobachten zu können“, beschreibt Erstautor Martin Kubitschke aus der Arbeitsgruppe Synthetische Biologie an der Universität Bremen, dessen Forschung vom SFB 874 unterstützt wurde. „Während andere Teams ihren Fokus auf die Botenstoffe Glutamat, Dopamin, Noradrenalin oder Acetylcholin legten, wollten wir genau verstehen, welche Funktionen Serotonin im Gehirn hat. Als wir mit der Entwicklung der Sensoren begannen, gab es noch keine Möglichkeit Serotonin im Gehirn live zu beobachten.“
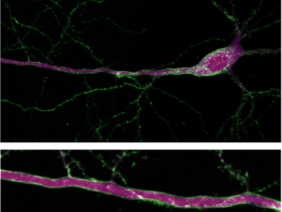
Als Gerüst der neuartigen‚sDarken‘-Sensorennutzen die Forscher*innen einen natürlich vorkommenden, menschlichen 5-HT1A-Rezeptor. Dieser wurde gentechnisch mit Hilfe eines grün-fluoreszierenden Proteins verändert, dass sDarken im ungebundenen Zustand grün leuchtet. Der entscheidende Mechanismus dahinter: Sobald Serotonin an die Sensoren andockt, nimmt seine Leuchtkraft ab. Verdunkelung gibt also einen direkten Hinweis auf die Aktivität von Serotonin. Da es sich um einen genetisch enkodierten Sensor handelt, können beliebige Nervenzellentypen oder Hirnregionen mit diesem Sensor zur Visualisierung von Serotonin-Dynamiken versehen werden.
Schnelle Reaktionsgeschwindigkeit, gute Position, hohe Leuchtkraft
Bemerkenswert war die sehr gute Auflösung, die sowohl zeitlich als auch räumlich bei Messungen erzielt werden konnte. „Wir haben mit Hilfe der ‚Patch-Clamp-Fluorometry‘ festgestellt, dass ‚sDarken‘ bereits in Sekundenbruchteilen auf Änderungen der Serotoninkonzentration reagiert“, beschreibt Prof. Dr. Andreas Reiner von der Fakultät für Biologie und Biotechnologie der Ruhr-Universität Bochum. „Bei der räumlichen Bestimmung der Botenstoff-Aktivität hilft uns, dass ‚sDarken‘ hervorragend in der Membran der Nervenzellen positioniert ist“, ergänzt Professor Dr. Olivia Masseck, Letztautorin und Leiterin der Arbeitsgruppe Synthetische Biologie an der Universität Bremen. „Die ‚sDarken‘-Familie funktioniert so hervorragend, dass wir davon ausgehen, in Zukunft sogar Aktivitäten an einzelnen Spines der Nervenzellen sichtbar machen zu können.“
Die Sensoren arbeiten überaus sensibel und spezifisch: Kleinste Konzentrationen von Serotonin führten bereits zu einer optischen Veränderung der Sensoren und konnten so von den Wissenschaftlerinnen und Wissenschaftlern gemessen werden. Bei Gabe anderer Neurotransmitter oder ähnlicher Substanzen reagierte ‚sDarken‘ nicht. Zudem zeigte sich ‚sDarken‘ als äußerst robust, photo- und pH-stabil und erfüllte somit wichtige Voraussetzungen für die Langzeitbildgebung.
„Insgesamt haben wir durch gezielte Mutation drei verschiedene Varianten von ‚sDarken‘ entwickelt, die unterschiedlich empfindlich auf Serotonin reagieren“, erläutert Martin Kubitschke weiter. „Für die Erfassung der sogenannten Volumenübertragung bei Neurotransmittern ist es vorteilhaft, einen Sensor mit einer sehr hohen Affinität zu verwenden. Liegt der Fokus hingegen auf Serotonin-Ausschüttungen über einzelne Synapsen, ist ein Sensor mit geringerer Affinität vorteilhaft. All diese Ausprägungen sind nun durch die ‚sDarken‘-Familie abgedeckt.“
Ideale Ergänzung bestehender Serotoninsensoren
Ihre Eigenschaften machen ‚sDarken‘ zu einer idealen Ergänzung bestehender Serotoninsensoren und erweitern das Instrumentarium für die Bildgebung der Serotonin-Dynamik. In Zusammenarbeit mit den Forscherteams der Ruhr-Universität Bochum (Prof. Dr. Andreas Reiner), dem DZNE in Bonn (Dr. Martin Fuhrmann) und dem ZNMH in Hamburg (Prof. Dr. Simon Wiegert) konnte bereits gezeigt werden, dass sich mit sDarken im wachen, aktiven Tier sogar feine Details bei der Serotoninausschüttung beobachten lassen. Olivia Masseck ist daher überzeugt: „Die neuen Sensoren werden es langfristig ermöglichen, Aufgabe und Funktionsweise von Serotonin im Gehirn besser zu verstehen.“
Universität Bremen
Originalpublikation:
Kubitschke, M., Müller, M., Wallhorn, L. et al. Next generation genetically encoded fluorescent sensors for serotonin. Nat Commun 13, 7525 (2022): https://doi.org/10.1038/s41467-022-35200-w