Ohne Proteine wäre das Leben, wie wir es kennen, nicht vorstellbar. Sie geben als Baugerüst den Zellen ihre Form, kontrollieren als Enzyme die chemischen Reaktionen des Stoffwechsels und erlauben als Membranrezeptoren, Transporter oder Signalstoffe die Kommunikation der Zellen mit ihrer Umwelt. All diese Funktionen können Proteine nur ausfüllen, wenn sie sich am richtigen Ort innerhalb der Zelle befinden. Oft verändert sich sogar die Beschaffenheit eines Proteins, wenn es den Ort wechselt – Kontrolle über seine Lokalisation in der Zelle bedeutet daher auch Kontrolle über seine Funktion.
Will man die Funktion von Proteinen verstehen und erforschen, ist es daher essentiell, ihren Aufenthaltsort exakt zu bestimmen und den Weg, den sie in der Zelle zurücklegen, verfolgen zu können. Denn Proteine wechseln oft zwischen verschiedenen Organellen und Kompartimenten der Zelle dynamisch hin und her. Um sie im Mikroskop sichtbar zu machen, verknüpft man sie mit einem fluoreszierenden, hell leuchtenden Proteinanteil. Doch bisher hatte diese Methode mit technischen Schwierigkeiten zu kämpfen: Normalerweise ließ sich der fluoreszierende Teil nur an jeweils ein einzelnes Protein gleichzeitig anbringen, um mehrere Proteine damit zu markieren musste man die Zellen meist abtöten und fixieren.
Die von Stefan Kubiceks Gruppe vorgestellte neue Methode „visual proteomics Cells“ (abgekürzt vpCells) erlaubt es dagegen, Proteine so mit Fluoreszenz zu markieren, dass ihre endogenen Regulationsmechanismen unverändert bleiben. Anstatt ein Protein nach dem anderen zu markieren, können damit viele Proteine gleichzeitig in einem sogenannten Multiplex-Ansatz mit einem Fluoreszenzprotein fusionieren. Ein Vorläufer dieser Methode wurde von Kubiceks Team bereits 2020 beschrieben, um metabolische Enzyme zu studieren (Reicher et al. Genome Res. 2020, DOI: 10.1101/gr.261503.120). Nun wurde sie auf drei Arten erweitert und verbessert:
Erstens können mit vpCells alle theoretisch möglichen Proteine markiert werden. Dazu wird die Genschere CRISPR/Cas9 eingesetzt, um die Fluoreszenzproteine genetisch an die zu untersuchenden Proteine anzuhängen. Kubiceks Gruppe hat dazu eine genomweite „Bibliothek“ erstellt, mit der sämtliche Proteine menschlicher Zellen fluoreszent markiert werden können und mit der man nun systematisch an deren Erforschung gehen kann.
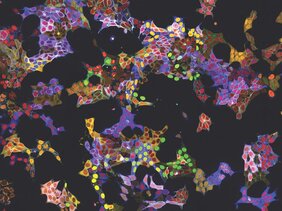
Zweitens benutzt vpCells nicht nur eine Fluoreszenzfarbe, sondern insgesamt fünf komplementäre Farben. In jeder Zelle werden zwei unterschiedliche Proteine, die verfolgen werden sollen, markiert. Zusätzlich wird eine weitere Farbmarkierung eingesetzt, um die einzelnen Klone besser unterscheiden zu können. Und mit zwei weiteren Farben werden Zellkern und Zellmembran markiert, um einzelne Zellen besser abgrenzen zu können.
Drittens können mit diesem Farbspiel nicht nur großartig anzusehende Bilder generiert werden, sondern die unterschiedlichen Proteine auch in einer riesigen Zahl an lebenden Zellen rein optisch erkannt werden. Normalerweise erfordert dies im Anschluss an die Bildgebung eine komplexe DNA-Sequenzierung, um herauszufinden, welches Protein markiert ist. VpCells ermöglicht es dagegen, eine KI-unterstützter Bilderkennung darauf zu trainieren, dass sie allein aufgrund der Fluoreszenzmikroskopiebilder erkennen kann, welches Protein in welcher Zelle markiert ist.
Die Methode hat in zwei Anwendungen bereits ihr Potential unter Beweis gestellt: Einerseits wurden damit mehr als 4,500 Zelllinien als Reporter für mehr als 1,100 Proteine hergestellt. Diese Zelllinien wurden dazu benutzt, um die KI-Modelle zu trainieren und Aussagen über die Lokalisation der Proteine im Grundzustand zu treffen. Alle Bilder der einzelnen markierten Proteine finden sich auf der öffentlich zugänglichen Web-Datenbank vpcells.cemm.at.
Andererseits konnten die lebenden Reporterzellen für eine konkrete Forschungsfrage eingesetzt werden: Kubiceks Team untersuchte den Effekt von mehr als 1000 niedermolekularen Substanzen auf 61 Proteine, die für Krebszellen relevant sind. Dabei fanden die Forschenden heraus, dass 44 der getesteten Substanzen innerhalb von 6 Stunden die Menge oder die Lokalisation einzelner Proteine veränderten. Eine der Substanzen stellte sich als Inhibitor für den Transport von Proteinen aus dem Zellkern heraus, der eine ähnliche Wirkung aufweist wie ein klinisch zugelassenes Medikament gegen multiples Myelom, eine Krebserkrankung des blutbildenden Systems.
„Diese Ergebnisse geben einen ersten Einblick in die Versatilität der vpCells Methode“. So Kubicek. „Wir erwarten viele weitere zukünftige Anwendungsmöglichkeiten der damit erzeugten Zellinien, von fundamentaler Zellbiologie bis zur anwendungsnahen Wirkstoffsuche.“
CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften
Originalpublikation:
Reicher, A., Reiniš, J., Ciobanu, M. et al. Pooled multicolour tagging for visualizing subcellular protein dynamics. Nat Cell Biol (2024). doi.org/10.1038/s41556-024-01407-w