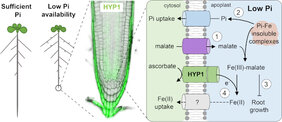
Die Freisetzung von Carboxylaten wie Malat wird von vielen Pflanzen genutzt, um schlecht verfügbaren Phosphor (P) aus dem Boden zu gewinnen. Malat kann die Verfügbarkeit von Phosphat, also der von Pflanzen aufgenommenen P-Form, erhöhen, indem es an Phosphat gebundenes dreiwertiges Aluminium oder Eisen (Fe) chelatisiert. Arbeiten aus den letzten Jahre haben gezeigt, dass die Anhäufung von Fe(III)-Malat-Komplexen im Apoplast der Wurzelspitze das Wachstum der Wurzel unter P-armen Bedingungen abschwächt. Grund ist, das das nun lösliche Fe(III) an Reaktionen beteiligt ist, die zu oxidativem Stress führen. Wie die Wurzelspitzen mit dieser erhöhten Verfügbarkeit von Eisen(III) zurechtkommen, ist jedoch nicht klar, da alle bisher bekannten Eisen(III)-Reduktasen, die für die Fe-Aufnahme erforderlich sind, durch P-Mangel unterdrückt oder in den Wurzelspitzen gar nicht exprimiert werden.
„Bei der Suche nach anderen Eisen(III)-Reduktasen unter den P-Mangel-induzierten Genen fanden wir ein bislang nicht charakterisiertes Gen, das für eine Domäne kodiert, von der man annimmt, dass sie an der Eisen(III)-Reduktion beteiligt ist“, erklärt Dr. Ricardo Giehl, Co-Leiter der IPK-Forschungsgruppe „Molekulare Pflanzenernährung“. „Als wir das Gen ausschalteten, kam es zu einer Überakkumulation von Fe in den Wurzelspitzen, und das Wurzelwachstum wurde bei niedrigem P noch stärker gehemmt“, erläutert er die Ergebnisse, die heute in der Fachzeitschrift "Nature Communication" veröffentlicht worden sind.
Das Gen erhielt daher den Namen HYPERSENSITIVE TO LOW P1 (HYP1). HYP1 gehört zur CYBDOM-Familie und besitzt eine Cytochrom b561-Domäne. Diese kommt in Eisenreduktasen von mehrerer tierischer Zellen vor, wie z. B. dem duodenalen Cytochrom b (Dcytb). Dies ist beim Menschen an der Aufnahme von Eisen aus der Nahrung beteiligt. „Obwohl CYBDOMs aus zahlreichen Organismen bekannt sind und in Pflanzen oft als große Familien vorkommen, ist ihre Funktion im Allgemeinen noch schlecht verstanden“, erklärt Rodolfo Maniero, Erstautor der Studie.
Mithilfe einer Modellierung durch AlphaFold und Mutagenese an Protein-Sequenzen fanden die Forscher heraus, dass HYP1 drei b-Häm-Gruppen koordinieren kann, die für die Aktivität des Proteins entscheidend sind. Die elektrophysiologische Charakterisierung von HYP1 in Eizellen von Froschen ergab, dass das Protein Elektronen aus Ascorbat (Vitamin C) durch die Plasmamembran transportieren kann. Akzeptoren für diese Elektronen sind Fe(III) und Cu(II) (Kupferionen). Und das deutet darauf hin, dass das Protein eine Metalloreduktase ist.
„Was die Eisen(III)-Reduktase-Aktivität von HYP1 betrifft, so zeigen unsere Ergebnisse, dass diese Funktion entscheidend ist, um eine Malat-induzierte Fe-Überakkumulation im Apoplast zu verhindern“, erklärt Dr. Ricardo Giehl. „Außwerdem werden die Zelldehnung und die Integrität des Meristems in Wurzelspitzen, die niedrigem P ausgesetzt sind, aufrechterhalten“, sagt der Wissenschaftler. „Unsere Ergebnisse deuten auch darauf hin, dass ein Fe-Aufnahmemechanismus in den Wurzelspitzen aktiv ist, wo die bekannte Eisen(III)-Reduktase FRO2 und der Fe(II)-Transporter IRT1 nicht vorhanden sind.“ Die Studie wirft nicht nur ein Licht auf die physiologische Rolle der CYBDOMs, sondern identifiziert auch ein neues Ziel zur Verbesserung des Wurzelwachstums unter limitierenden P-Bedingungen.
IPK-Leibniz-Institut
Originalpublikation:
Maniero, R.A., Picco, C., Hartmann, A. et al. Ferric reduction by a CYBDOM protein counteracts increased iron availability in root meristems induced by phosphorus deficiency. Nat Commun15, 422 (2024). doi.org/10.1038/s41467-023-43912-w