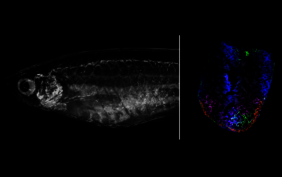
Wenn ein Mensch einen Herzinfarkt erleidet und nicht schnell behandelt wird, sterben durch den Sauerstoffmangel geschädigte Herzmuskelzellen ab. Es bildet sich Narbengewebe. Weil sich daraus keine neuen Herzmuskelzellen (Kardiomyozyten) entwickeln können, sinkt die Pumpleistung des Herzens. Ganz anders bei niederen Wirbeltieren wie dem Zebrafisch: Er kann Organe regenerieren – auch sein Herz.
„Wir wollten wissen, wie der kleine Fisch das macht und ob wir daraus lernen können“, sagt Professor Jan Philipp Junker, Leiter der Arbeitsgruppe „Quantitative Entwicklungsbiologie“ am Berliner Institut für Medizinische Systembiologie (BIMSB) des Max-Delbrück-Centrums für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) in Berlin. Zusammen mit Dr. Daniela Panáková, die am MDC die AG „Elektrochemische Signalübertragung in der Entwicklung und bei Krankheiten“ leitet, simulierten die Wissenschaftler*innen infarktähnliche Verletzungen am Zebrafischherz. Anhand von Einzelzellanalysen und Zellstammbäumen verfolgten sie, wie sich die Herzmuskelzellen regenerierten. Ihre Beobachtungen beschreiben sie nun im Fachmagazin „Nature Genetics“.
Beim Menschen stoppt der Prozess
Zunächst berührten sie das nur einen Millimeter große Fischherz unter dem Mikroskop für wenige Sekunden mit einer kalten Nadel. Das betroffene Gewebe stirbt dort ab. Genau wie bei Infarktpatient*innen kommt es zunächst zu einer Entzündungsreaktion, dann bildet sich eine Narbe aus Bindegewebszellen, den Fibroblasten. „Überraschenderweise ist die unmittelbare Antwort auf die Verletzung ganz ähnlich. Doch während der Prozess beim Menschen an dieser Stelle stoppt, geht er beim Fisch weiter. Es bilden sich neue kontraktionsfähige Kardiomyozyten“, erklärt Junker.
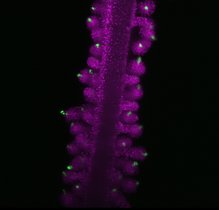
„Wir wollten wissen, welche Signale von anderen Zellen kommen und dazu beitragen, diese Regeneration zu steuern“, fährt er fort. Mithilfe der Einzelzell-Genomik durchsuchte Junkers Team das verletzte Herz nach Zelltypen, die es im gesunden Fischherz nicht gibt. Die Forscher*innen fanden dabei drei neue Fibroblasten-Varianten, die vorübergehend in einen aktivierten Zellzustand übergehen. Äußerlich identisch mit den üblichen Fibroblasten, lesen diese aktivierten Zellen eine ganze Reihe von zusätzlichen Genen ab, die für die Bildung von Proteinen zuständig sind – unter anderem Bindegewebsfaktoren wie das Kollagen-12.
Fibroblasten geben Signal für Regeneration
Die Narbenbildung (Fibrose) wird beim Menschen eigentlich als Hindernis für die Regeneration des Herzens angesehen. Aber die Bindegewebszellen sind anscheinend für den Prozess wichtig, sobald sie vorübergehend in einen aktivierten Zustand übergehen. Wie wichtig zeigte sich, als Daniela Panáková mit Hilfe eines genetischen Tricks die Kollagen-12-bildenden Fibroblasten im Zebrafisch gezielt ausschaltete. Die Regeneration blieb aus. Dass es ausgerechnet Fibroblasten sind, die Signale für die Reparatur geben, ist aus Junkers Sicht sogar sinnvoll. „Denn sie entstehen ja genau am Ort der Verletzung“, sagt der Zellbiologe.
Um den Ursprung dieser aktivierten Fibroblasten zu finden, erstellte Junkers Team mithilfe einer 2018 in seinem Labor entwickelten Technik namens LINNAEUS Zellstammbäume. Die Technik beruht auf Narben im Erbgut, deren Kombination wie ein Barcode für die Herkunft jeder Zelle funktioniert. „Dieser Barcode entsteht mithilfe der Genschere CRISPR/Cas9. Wenn nach der Verletzung zwei Zellen die gleiche Barcodesequenz aufweisen, müssen sie miteinander verwandt sein“, erläutert Junkers das Prinzip. Die Wissenschaftler*innen machten zwei Quellen für vorübergehend aktivierte Fibroblasten aus: die äußere Herzgewebsschicht, das Epikard, und die innere, das Endokard. Zellen, die Kollagen-12 produzieren, fanden die Forschenden ausschließlich im Epikard.
Intensive Zusammenarbeit verschiedener Forschungsdisziplinen
Für die Studie arbeiteten mehrere MDC-Wissenschaftler*innen Hand in Hand – angefangen bei den Versuchen mit den Fischen über die Genanalyse bis hin zur bioinformatischen Interpretation der Ergebnisse. „Das Spannendste war für mich zu sehen, wie gut sich unsere Disziplinen ergänzen und wie sich die Resultate der Bioinformatik an einem lebenden Tier verifizieren lassen“, sagt Sara Lelek, Erstautorin der Studie und verantwortlich für die Tierversuche. „Es war ein großes Projekt, zu dem jeder sein Fachwissen beitragen konnte. Ich denke, das macht die Studie so umfassend und nützlich für viele Forschende.“
Dr. Sebastiaan Spanjaard, ebenfalls Erstautor, sieht das ähnlich. „Aufgrund unserer sehr verschiedenen Expertisen mussten wir uns regelmäßig gegenseitig unsere Experimente und Analysen erklären. Die Herzregeneration ist ein komplexer Prozess mit vielen Einflüssen. Die Datenmengen, die bei den Experimenten herauskommen, sind riesig. Daraus die richtigen biologischen Signale herauszufiltern, war eine große Herausforderung.“
Noch ist unklar, ob es dem geschädigten Herz von Säugetieren wie Mensch und Maus an entsprechenden Signalen fehlt – oder an der Fähigkeit, die Signale auszulesen. Fehlende Signale ließen sich wohl irgendwann durch entsprechende Medikamente imitieren. Eine fehlende Signalinterpretation nachzustellen, wäre sehr viel schwieriger, meint Jan Philipp Junker.
Fibroblasten auch an neuen Blutgefäßen beteiligt
Als nächstes wollen die Forschenden sich die Gene genauer ansehen, die die vorübergehend aktivierten Fibroblasten besonders oft ablesen. Bekannt ist, dass darunter etliche sind, die für die Ausschüttung von Proteinen in die Umgebung wichtig sind. Darunter könnten Faktoren sein, die auch die Kardiomyozyten beeinflussen. Zudem gibt es erste Hinweise, dass die regenerationsfördernde Funktion dieser Fibroblasten im aktivierten Zellzustand nicht nur auf die Herzmuskelzellen, sondern auch auf die Bildung neuer Blutgefäße abzielt, die das Herzgewebe mit Sauerstoff versorgen.
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft
Originalpublikation:
Bo Hu et al (2022): „Origin and function of activated fibroblast states during zebrafish heart regeneration”. Nature Genetics, DOI: 10.1038/s41588-022-01129-5, doi.org/10.1038/s41588-022-01129-5