Proteine sind kleine molekulare Werkzeuge und Baustoffe, die alle lebenswichtigen Prozesse in unserem Körper ermöglichen und steuern. Es gibt riesige Netzwerke, die von tausenden verschiedenen Proteinen und deren Interaktionen gebildet werden.
Das Protein 14-3-3 ist besonders stark vernetzt. „Es ist ein wichtiges Schlüsselprotein und reguliert je nach Partner unterschiedliche Prozesse, wie z.B. die Zellteilung“, so Professor Christian Ottmann, der innerhalb des Sonderforschungsbereichs 1093 an der UDE neue Methoden entwickelt, um die Interaktionen von Proteinen mit kleinen Molekülen, sogenannten Liganden, zu beeinflussen.
Bei der Behandlung von neurodegenerativen Erkrankungen wie Alzheimer und Parkinson oder zur Bekämpfung von Tumorerkrankungen wäre es wünschenswert, die Zusammenarbeit des 14-3-3-Proteins mit einem bestimmten Partner zu stärken. „Die Stabilisierung von Protein-Protein-Wechselwirkungen ist allerdings eine Herausforderung“, so der Wirkstoffforscher, der ebenfalls an der Universität Eindhoven forscht. Es gibt bisher nur sehr wenige, dafür hochwirksame Medikamente, deren Wirkstoffe nach diesem Prinzip funktionieren.
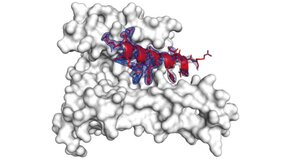
Doch dem Team um Ottmann ist es vor Kurzem gelungen, ein kleines „Klebemolekül“ zu entwickeln, das sowohl an das 14-3-3-Protein als auch an die Oberfläche eines zweiten Proteins bindet. Es sitzt wie ein flachgedrücktes Kaugummi passgenau zwischen den beiden Oberflächen und verpflichtet die Partner zur Teamarbeit. Die Ergebnisse, die eine hohe Aktivität des zusammengeschweißten Proteinkomplexes zeigen, wurden kürzlich in der renommierten Fachzeitschrift Nature Communications veröffentlicht.
UDE
Originalartikel:
Sijbesma, E., Visser, E., Plitzko, K. et al. Structure-based evolution of a promiscuous inhibitor to a selective stabilizer of protein–protein interactions. Nat Commun11, 3954 (2020).