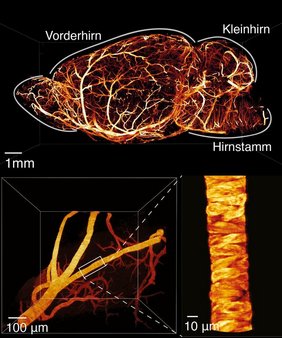
Anhand detaillierter Scans lassen sich zum Beispiel feine Netzwerke aus Nervenbahnen oder Blutgefäßen genauer untersuchen. Ein Team der Universität und Universitätsmedizin Göttingen (UMG) hat die Plattform zusammen mit Forschenden der Universität Lübeck und im Rahmen des Göttinger Exzellenzclusters „Multiscale Bioimaging: Von molekularen Maschinen zu Netzwerken erregbarer Zellen“ (MBExC) entwickelt. Die Ergebnisse wurden in der Fachzeitschrift Nature Biotechnology veröffentlicht.
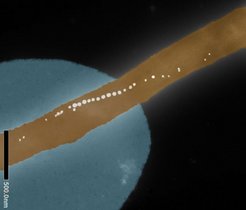
Das System erfasst Details bis auf 850 Nanometer klar. Das entspricht etwa einem Hundertstel der Breite eines menschlichen Haars. Es schafft zudem 100 Bilder pro Sekunde von Proben mit einem Volumen von einem Kubikzentimeter – so groß wie ein Stück Würfelzucker. Dabei erscheint das 3D-Objekt nicht in Teilen verschwommen, sondern mit gleichmäßig hoher Auflösung. Erreicht wird das durch handelsübliche Bauteile vereint mit neuen Merkmalen: Während das Lichtblatt die Probe beleuchtet, wird es ständig nachjustiert. Zusätzlich verringern gezielte Korrekturen optische Fehler. „Dank dieser Innovation können wir große, geklärte Gewebeproben so schnell und detailgenau wie nie zuvor dreidimensional erfassen“, sagt Prof. Dr. Jan Huisken von der Universität Göttingen. Solche Proben wurden durch chemische Verfahren durchsichtig gemacht, damit das Licht in die Tiefe vordringt. „Jede Methode des Clearings verändert das Gewebe optisch ein wenig anders. Das beeinflusst, wie stark das Gewebe das Licht ablenkt. Viele Mikroskope haben damit Probleme. Doch unser System liefert bei wechselnden Brechungsindizes scharfe 3D-Bilder“, so Huisken.
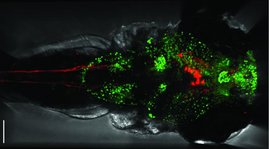
Zur Anwendung kommt das System zum Beispiel, um die Verbindungen von Nervenzellen in der Hörschnecke (Cochlea) der Maus genau zu kartieren. „Diese 3D-Darstellung ermöglichte es uns, die Detailstruktur der Cochlea auf Einzelzellniveau bei Gesundheit und Krankheit zu untersuchen und so neue Erkenntnisse über ihre Funktion zu gewinnen“, erklärt MBExC-Sprecher Prof. Dr. Tobias Moser, Direktor des Instituts für Auditorische Neurowissenschaften an der UMG.
„Unsere Plattform ist kompakt, robust und leicht reproduzierbar, da sie auf zugänglichen Komponenten basiert“, so Erstautor Dr. Mostafa Aakhte von der Universität Göttingen, der entscheidend zu Entwicklung und Bau des Mikroskops sowie zu den Messungen beigetragen hat. „Sie ist nicht nur für die Grundlagenforschung interessant. Auch in der medizinischen Praxis kann sie zur Anwendung kommen, zum Beispiel in der Diagnostik und in der Planung komplizierter Operationen.“
Universität Göttingen
Originalpublikation:
Aakhte, M. et al. Isotropic, aberration-corrected light sheet microscopy for rapid high-resolution imaging of cleared tissue. Nature Biotechnology (2025). https://doi.org/10.1038/s41587-025-02882-8