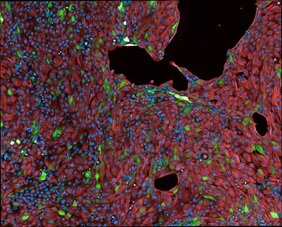
Wenn wir atmen, gelangt das SARS-CoV-2-Virus über die Zellen der oberen Atemwege in den Körper. Die erste Verteidigungslinie sind die Epithelzellen: Nehmen sie einen Eindringling wahr, schlagen sie Alarm und das angeborene Immunsystem greift gezielt an. Nur wenn sie diese Reaktionen verstehen und pharmakologisch beeinflussen können, können Forschende wirksame Behandlungen gegen Viruskrankheiten wie COVID-19 oder andere neuauftretende Infektionen entwickeln. Für solche Analysen haben Forschende am Max Delbrück Center Lungenepithelzellen im Labor so modifiziert, dass sie rot aufleuchten, sobald eine Zelle eine Immunantwort auslöst. Die Ergebnisse stellt Dr. Gaetano Gargiulo, Leiter der Arbeitsgruppe „Molecular Oncology“ am Max Delbrück Center nun im Fachjournal „Science Advances“ vor.
Ursprünglich haben Gargiulo und sein Team diesen Ansatz für die Krebsforschung entwickelt. Doch während der Pandemie haben sie ihre Methode auch an virusinfizierten Zellen erprobt. „Unser Team wollte seinen Teil zur Bewältigung der Pandemie beitragen – mit einem Werkzeug, um Virusinfektionen zu erforschen und zu bekämpfen“, sagt Gargiulo, der Letztautor der Studie. „Möglicherweise können wir künftige Pandemien rascher bewältigen, wenn wir die Technologie auf neuartige Virusstämme anpassen.“
Die Immunantwort in Echtzeit
Das Werkzeug namens „synthetische Locus-Kontrollregion“ (sLCR) besteht aus einem im Labor erzeugten DNA-Abschnitt, der ein fluoreszierendes Protein an- oder ausschaltet – abhängig davon, ob die Zelle eine Immunantwort anstößt. Während einer angeborenen Immunantwort schaltet sich sLCR ein und bildet ein Protein, das unter einem Fluoreszenzmikroskop rot leuchtet. So kann man erkennen, ob die Zelle die Infektion registriert hat und wie stark sie dagegen ankämpft.
Für ihre sLCR nutzten die Forschenden einzigartige DNA-Sequenzen: Anhand früherer Studien gingen sie davon aus, dass sie während einer SARS-CoV-2-Infektion aktiv sind. In der Petrischale fügten sie anschließend die Sequenzen in Epithelzellen ein und infizierten die Zellen mit dem SARS-CoV-2-Virus. Sobald die biochemischen Signale der angeborenen Immunantwort eine Infektion veranlassten, zeigte sich unter einem Fluoreszenzmikroskop ein deutliches Signal: Die Zellen leuchteten rot auf.
„Am spannendsten fand ich, dass die Infektion mit verschiedenen Stämmen des lebenden Virus tatsächlich die Farbkodierung auslöste“, sagt Ben Jiang, Doktorand in der Arbeitsgruppe von Gargiulo und einer der Erstautor*innen der Studie. Möglich waren die Experimente mit lebenden Virenpartikeln dank der Zusammenarbeit zwischen dem Team am Max Delbrück Center und der Gruppe von Luka Cicin-Sain am Helmholtz-Zentrum für Infektionsforschung (HZI) in Braunschweig.
Neue Behandlungen für virale Erkrankungen finden
Dank dieser einfachen Auswertung konnten die Forschenden nach Medikamenten suchen, die die Immunantwort hemmen oder verstärken. Einige Medikamente gegen rheumatoide Arthritis etwa ließen die behandelten Zellen nicht rot aufleuchten – ein Hinweis darauf, dass sie die Immunantwort blockieren. Bestimmte Chemotherapien sorgten hingegen dafür, dass die Zellen intensiver leuchteten. Das deutet darauf hin, dass sie die Immunantwort verstärken.
Die unterschiedlichen Effekte könnten in verschiedenen Phasen einer COVID-19 Infektion nützlich sein. Ein Medikament, das eine starke Immunantwort hervorruft, würde am Anfang der Infektion im Kampf gegen das Virus helfen. Im späteren Verlauf könnte eine anhaltende Immunreaktion jedoch das Krankheitsbild verschlimmern. „Mit dieser Technologie können wir Wirkstoffe identifizieren, die die Immunantwort des Epithelgewebes stärken oder schwächen. Beides kann sinnvoll sein – je nach Krankheitsstadium und Symptomen“, erklärt Jiang.
Insbesondere die Entdeckung, dass DNA-schädigende Substanzen das Alarmsignal von Epithelzellen verstärken können, macht die niedrig dosierte Strahlentherapie zu einer potenziellen Behandlungsmethode für virale Infektionen, einschließlich COVID-19. Dies wurde während der Pandemie getestet, erfordert jedoch eine genaue Dosierung und gutes Timing, sagt Gargiulo.
Die vorliegende Studie wurde zwar an Zellkulturen durchgeführt, allerdings haben andere Forschungsgruppen die identifizierten Medikamente bereits in klinischen Studien zur COVID-19-Therapie untersucht. Die Ergebnisse von Gargiulo und seinem Team könnten also dabei helfen, neue Kombinationen und andere Wirkstoffe zu finden, die noch auf ihre Wirksamkeit beim Menschen hin überprüft werden müssen. „Diese Technologie könnte man auch mit komplexeren Krankheitsmodellen wie Organoiden oder Mäusen ausprobieren“, sagt Matthias Schmitt, ein weiterer Erstautor der Studie.
„Den gleichen Ansatz kann man problemlos für andere virale Infektionen umfunktionieren: etwa die aufkommende Bedrohung durch Dengue- und Zika-Viren“, sagt Gargiulo. „Und sie steht Laboren weltweit zur Verfügung, um rechtzeitig Medikamente gegen neue Infektionskrankheiten zu finden.“
Max Delbrück Center
Originalpublikation:
Ben Jiang, Matthias Jürgen Schmitt et al. (2023): „Pharmacological modulators of epithelial immunity uncovered by synthetic genetic tracing of SARS-CoV-2 infection responses“. Science Advances, DOI: 10.1126/sciadv.adf4975, https://www.science.org/doi/10.1126/sciadv.adf4975