Transkriptionsfaktoren spielen in allen Zellen und Organismen eine wesentliche Rolle bei der Umwandlung der in den Genen kodierten genetischen Information in Proteine. Transkriptionsfaktoren binden an die DNA, schalten Gene an oder aus und steuern die Geschwindigkeit, mit der die DNA in die für die Proteinsynthese notwendige mRNA umgeschrieben wird. Aufgrund ihrer zentralen Rolle bei der Transkriptionsregulation lassen sich viele Krankheiten auf defekte oder überaktivierte Transkriptionsfaktoren zurückführen. Die Hemmung ihrer Aktivität bietet therapeutisches Potenzial, doch viele Transkriptionsfaktoren haben einen Trick im Ärmel. Ihre Aktivierungsdomänen sind intrinsisch ungeordnet. Die Aminosäureketten, aus denen diese Domänen bestehen, haben keine klare dreidimensionale Struktur. Das Fehlen einer stabilen 3D-Struktur erschwert die Entwicklung von Medikamenten, die an die Aktivierungsdomänen binden. Das Forscherteam konzentrierte sich nun auf die Tendenz von intrinsisch ungeordneten Proteinen, biomolekulare Kondensate zu bilden. Sie fanden heraus, dass die an der Kondensation beteiligten Mechanismen genutzt werden könnten, um die Aktivität des Androgenrezeptors bei Prostatakrebs zu hemmen. "Die Logik der Optimierung eines Inhibitors des Androgenrezeptors könnte auch auf die Hemmung anderer Transkriptionsfaktoren angewendet werden und neue Möglichkeiten eröffnen, um bisher unerfüllte medizinische Bedürfnisse zu befriedigen", sagt Dr. Salvatella vom Institute for Research in Biomedicine (IRB, Barcelona).
Zelluläre Tröpfchen als neuer Ansatzpunkt
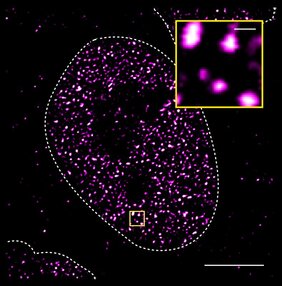
Biomolekulare Kondensate sind winzige Proteinklumpen, die unter dem Mikroskop auf Wasser schwimmenden Tröpfchen ähneln. Die Kondensate entstehen durch einen Prozess, der als Entmischung oder Phasenseparation bezeichnet wird. Dabei trennen sich zwei nicht mischbare Flüssigkeiten in zwei Phasen, ähnlich wie Öl und Wasser. "Wir hatten zuvor beobachtet, dass der Androgenrezeptor biomolekulare Kondensate bildet, wenn man den Zellen selbst winzige Mengen eines aktivierenden Moleküls wie Testosteron zuführt", sagt Shaon Basu, einer der Erstautoren der Studie, der jetzt als Computerbiologe an der Berliner Charité arbeitet. Die Wissenschaftler vermuteten, dass es einen Zusammenhang zwischen der Aktivierung des Androgenrezeptors und seiner Neigung zur Tröpfchenbildung geben könnte. In Zusammenarbeit mit dem Biophysiker Xavier Salvatella identifizierten sie mit Hilfe der NMR-Spektroskopie mehrere kurze Abschnitte innerhalb der Aktivierungsdomäne, die für die Phasentrennung entscheidend sind. Außerdem zeigte sich, dass dieselben Abschnitte auch bei der Aktivierung von Genen durch den Rezeptor eine Rolle spielen. "Wir haben kurze Sequenzen in der Aktivierungsdomäne entdeckt, die ungeordnet sind, wenn das Protein löslich ist, und überraschenderweise scheinen diese Regionen stabilere Strukturen zu bilden, wenn das Protein in Kondensaten konzentriert ist", erklärt Denes Hnisz. Diese Strukturen bilden temporäre Angriffspunkte, an die Inhibitoren binden können, wenn der Rezeptor in Kondensaten vorliegt.
Verbesserte Wirkstoffe für die Behandlung von Prostatakrebs
In Zusammenarbeit mit Antoni Riera (IRB) und Marianne Sadar (University of British Columbia, Vancouver) verbesserte das Team einen experimentellen Hemmstoff. Anschließend testeten sie in Zell- und Mausmodellen, ob diese Veränderungen die Wirksamkeit bei einer aggressiven Form von Prostatakrebs erhöhen würden. "Wir haben die chemischen Eigenschaften des Wirkstoffs so verändert, dass sie mit den Eigenschaften der Androgenrezeptor-Kondensation übereinstimmen, was zu einer Verzehnfachung der Wirksamkeit des Moleküls bei kastrationsresistentem Prostatakrebs führte", sagt Paula Martínez-Cristobal, ebenfalls Erstautorin der Studie vom IRB Barcelona. "Das ist von großer Bedeutung, denn kastrationsresistenter Prostatakrebs ist ein extrem aggressiver Krebs, der gegen die derzeit eingesetzten Mittel der ersten Wahl resistent ist", fügt sie hinzu. Jedoch sind weitere Forschungsarbeiten notwendig, bis diese Erkenntnisse für die Entwicklung neuer und sicherer Medikamente genutzt werden können, so die Autor*innen. Das Team hofft, dass die grundlegenden Mechanismen auch auf andere Transkriptionsfaktoren übertragbar sind und damit die Möglichkeit eröffnen, diese wichtigen Moleküle gezielt gegen viele verschiedene Krankheiten einzusetzen. "Wir glauben, dass die Idee, dass es bestimmte Sequenzen innerhalb intrinsisch ungeordneter Proteindomänen gibt, die in Kondensaten eine vorübergehend stabile Struktur annehmen, universell ist und wahrscheinlich auch auf andere Transkriptionsfaktoren übertragen werden kann", schließt Denes Hnisz.
MPI für Molekulare Genetik
Originalpublikation:
Basu S., Martínez-Cristóbal, P. et.al. Rational optimization of a transcription factor activation domain inhibitor. Nature Structural & Molecular Biology 2023, https://doi.org/10.1038/s41594-023-01159-5