Die Erbsubstanz DNA kann auf ganz unterschiedliche Weise geschädigt werden, wodurch Krankheiten wie beispielsweise Krebs entstehen können. Gewisse DNA-Schäden können durch sogenannte R-Schleifen oder auf Englisch „R-loops“ verursacht werden. Hierbei handelt es sich um dreisträngige Strukturen aus zwei DNA- und einem RNA-Strang, wobei einer der DNA-Stränge eine Schleife bildet. Die Anzahl der Schleifen muss stark reguliert sein, damit im Genom keine Instabilität entsteht und dadurch Schäden auftreten. Wissenschaftlerinnen und Wissenschaftler am Institut für Molekulare Biologie (IMB) in Mainz haben eine neue Methode entwickelt, um die Proteine rund um R-Loops in menschlichen Zellen zu ermitteln. Sie entdeckten dabei, dass ein Protein namens DDX41 dafür verantwortlich ist, die Bildung von R-Loops in Zellen zu regulieren – ein wichtiger Mechanismus, um genomischer Instabilität und Krankheiten vorzubeugen. Die Ergebnisse wurden in der Fachzeitschrift Nature Communications veröffentlicht.
R-Schleifen müssen gut ausbalanciert sein
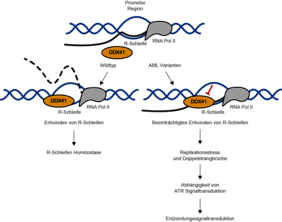
Die DNA enthält alle nötigen Informationen, damit unsere Zellen funktionieren. Sie liegt normalerweise als doppelsträngige Helix vor. R-Loops entstehen, wenn ein RNA-Strang an einen der beiden DNA-Stränge bindet und der andere DNA-Strang veranlasst wird, aus der einzelnen Kette eine Schleife zu bilden. Diese R-Schleifen sind wichtig, um die Gentranskription zu regulieren, erhöhen aber leider auch das Risiko von DNA-Schäden.
Um herauszufinden, wie die Zellen die Bildung von R-Schleifen ausbalancieren, sodass sie einerseits die Transkription ermöglichen, andererseits aber das Risiko von DNA-Schäden minimieren, entwickelte das Forscherteam am IMB eine neue Methode. Das als RNA-DNA-Proteomik (RDPRox) bezeichnete Verfahren sucht nach Proteinen, die mit R-Schleifen assoziiert sind. Damit konnten die Wissenschaftlerinnen und Wissenschaftler Proteine identifizieren, die für die Regulation der R-Loop-Niveaus in menschlichen Zellen verantwortlich sein könnten.
Sie identifizierten auf diesem Weg DDX41, ein Protein, das bei Patienten und Patientinnen mit myelodysplastischem Syndrom und akuter myeloischer Leukämie häufig mutiert ist. Als sie die Menge des DDX41-Proteins im Experiment reduzierten, stellten sie einen dramatischen Anstieg der R-Schleifen und Doppelstrangbrüche der Zell-DNA fest. Dies deutet darauf hin, dass DDX41 dafür verantwortlich ist, das Niveau von R-Schleifen niedrig zu halten. Weitere Analysen zeigten, dass die Zunahme von R-Schleifen vor allem an den Promotoren hoch exprimierter Gene erfolgt und dass viele Promotoren mit vermehrten R-Schleifen auch einen Anstieg der Doppelstrangbrüche aufweisen.
Die Forschenden, darunter Prof. Dr. Petra Beli und Prof. Dr. Brian Luke, die jeweils Arbeitsgruppen am IMB leiten und Professuren am Institut für Entwicklungsbiologie und Neurobiologie der Johannes Gutenberg-Universität Mainz (JGU) innehaben, vermuten, dass die angehäuften R-Schleifen in Zellen mit mutiertem DDX41 die Replikation der DNA oder die Transkription stören, dadurch das Risiko von Doppelstrangbrüchen erhöhen und damit Krebs verursachen könnten. „Indem wir die Proteine identifizieren, die sich in der Nähe von R-Schleifen befinden, zeigen wir zum ersten Mal, dass die Stellen mit einer Anhäufung von R-Loops mit einer erhöhten Zerbrechlichkeit der DNA einhergehen“, teilt die Studienleiterin Petra Beli mit. Insgesamt wurden 612 solcher Proteine ermittelt. „Wir vermuten, dass die R-Loop-Akkumulation und eine mit genomischer Instabilität verbundene Entzündungsreaktion zur Entwicklung einer familiären akuten myeloischen Leukämie mit mutiertem DDX41-Protein beitragen kann“, schreiben die Autoren in Nature Communications. Diese Erkenntnisse könnten auch neue Therapiestrategien eröffnen.
Universität Mainz
Originalpublikation:
Thorsten Mosler et al.: R-loop proximity proteomics identifies a role of DDX41 in transcription-associated genomic instability
Nature Communications, 16. Dezember 2021, DOI: 10.1038/s41467-021-27530-y
https://www.nature.com/articles/s41467-021-27530-y