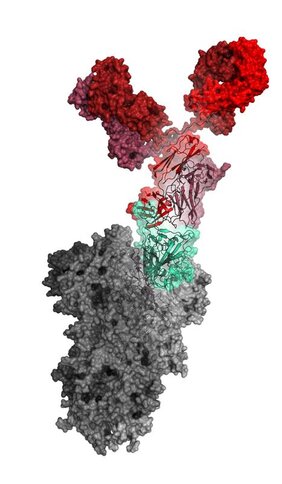
Für den ersten Schritt bei der Antikörperentwicklung wurden die Baupläne von Antikörpern, die an das Virus SARS-CoV-2 binden, aus den Blutzellen von genesenen COVID-19-Patienten gewonnen. Aus den gesammelten Antikörpergenen wurde eine molekulare Phage-Display-Bibliothek erstellt. Nahezu 200 unterschiedliche Antikörper gegen die Rezeptorbindestelle (RBD) des Hüllproteins (Spike) von SARS-CoV-2 wurden mit dem Phagen-Display-Verfahren im Reagenzglas isoliert. In den Laboren der Sicherheitsstufe 3 am Helmholtz-Zentrum für Infektionsforschung (HZI) wurden davon 30 Antikörper identifiziert, die das Eindringen von SARS-CoV-2 in Zellen effizient verhindern konnten. Hier zeigt der Antikörper COR-101 die beste Aktivität in der Neutralisierung der Viren.
Die Effizienz des Antikörpers wurde in transgenen Mäusen, die den menschlichen ACE2-Rezeptor tragen, und in Hamstern bestätigt. Die Viren konnten effizient reduziert oder komplett beseitigt werden. Die Struktur des Antikörpers und seiner Bindung an die Rezeptorbindestelle wurde auf atomarer Ebene aufgeklärt und zeigt, dass der Antikörper direkt das Andocken der Viren an die Zellen blockiert. COR-101 bindet und hemmt auch das Spike-Protein der neu auftretenden „indischen“ SARS-CoV-2-Varianten (B.1.617.1 und .3). Zusätzliche Daten, die nach der Publikation in „Cell Reports“ gewonnen wurden, zeigen, dass selbst die neue gefährliche “indische” Variante B.1.617.2 (Delta) effizient inhibiert wird.
Im Gegensatz zu den Antikörpern, die bisher in der EU eine Notfallzulassung bekommen haben und für die ambulante Behandlung von COVID-19-Patienten mit leichten bis mittleren Symptomen entwickelt wurden, wurde der Antikörper COR-101 speziell für die Behandlung von hospitalisierten Patienten, die akut eine therapeutische Behandlung benötigen, entwickelt. Dies wurde dadurch erreicht, dass der Teil des Antikörpers, der normalerweise das Immunsystem aktiviert, verändert wurde, und somit mögliche schädliche Reaktionen durch ein überschießendes Immunsystem verhindert werden.
Prof. Dr. Michael Hust (TU Braunschweig), leitender Autor der Studie und Mitinitiator der CORAT Initiative, sagt: “Die Entwicklung von COR-101 war nur in der engen gemeinsamen Zusammenarbeit unserer Forschungsgruppe mit der YUMAB GmbH und dem HZI möglich. Ich bin überzeugt, dass dieser Antikörper noch viele Menschenleben retten wird.”
Dr. Maren Schubert (TU Braunschweig), stellvertretende Leiterin der Studie, ergänzt: “Wir sind stolz auf die Resultate unserer Forschung und Entwicklung, die wir gleich im Februar 2020 mit der Produktion der SARS-CoV-2-Proteine in Insektenzellen begonnen haben.”
Prof. Dr. Stefan Dübel (TU Braunschweig), Erfinder der Antikörper Phagen-Display-Technologie, die zur Entdeckung dieses Antikörpers genutzt wurde, und Initiator der CORAT Initiative, betont: “Wir konnten zeigen, dass wir in kürzester Zeit einen effektiven therapeutischen Antikörpermedikamentenkandidaten entwickeln können. Dieses Wissen wird uns auch in Zukunft helfen, schneller und spezifischer bei der nächsten Pandemie reagieren zu können.”
Dr. Joop van den Heuvel, Strukturbiologe am HZI, ist “fasziniert vom Wirkmechanismus des Antikörpers“.
Prof. Dr. Dr. Luka Čičin-Šain, Leiter der Abteilung „Virale Immunologie“ am HZI, hebt hervor: „Das Beispiel COR-101 zeigt die besonderen Fähigkeiten der Region Braunschweig im Bereich der translationalen Infektionsforschung.”
Dr. André Frenzel, Wissenschaftlicher Leiter der YUMAB und CORAT GmbH, fügt abschließend hinzu: „Wir freuen uns auf die Daten der klinischen Studien mit COR-101, ein Antikörper, der die aktuelle Lücke bei der Behandlung von COVID-19-Patienten schließen kann.”
Zur Studie:
Die Studie entstand im Forschungsschwerpunkt Infektionen und Wirkstoffe der TU Braunschweig. Für die Untersuchungen wurde mit Mäusen und Hamstern gearbeitet. Die Tierversuche fanden am HZI und an der FU Berlin statt und wurden unter strengen Sicherheits- und Tierschutzauflagen durchgeführt.
TU Braunschweig
Originalpublikation:
Bertoglio, F. et al.: (2021). A SARS-CoV-2 neutralizing antibody selected from COVID-19 patients binds to the ACE2-RBD interface and is tolerant to most known RBD mutations. Cell Reports, Available online 7 July 2021, 109433
https://www.sciencedirect.com/science/article/pii/S2211124721008500