Bakterielle Biofilme sind häufig vorkommende Aggregate von Zellen, sie sichern den Mikroorganismen das Überleben in rauen Umgebungen. Diese Schichten sind sehr widerstandsfähig gegen mechanische und chemische Behandlungen. Für den Menschen können sie gefährlich sein, wenn sie etwa Oberflächen medizinischer Geräte oder in der Lebensmittelindustrie überziehen und sich darin Schadorganismen ansiedeln können.
Biofilme ermöglichen es Bakterien auch, genomische Informationen untereinander auszutauschen. Dadurch wird es für sie leichter, gegen Antibiotika Resistenzen zu entwickeln – wenn resistente Keime die Resistenzinformation an andere Spezies weitergeben. Auch helfen sie sich bei der Nährstoffaufnahme.
Gerade wenn Krankheitskeime Biofilme bilden, ist es wichtig zu verstehen, welche Mechanismen bei ihrer Bildung eine Rolle spielen. Dem hat sich die Arbeitsgruppe Synthetische Membransysteme der HHU um Prof. Dr. Alexej Kedrov zusammen mit Kollegen der LMU München und der Universität Groningen in den Niederlanden gewidmet. Sie haben sich auf den Krankheitserreger Pseudomonas aeruginosa (kurz P. aeruginosa) konzentriert, der beim Menschen unter anderem Lungenentzündungen, Harnwegsinfekte und Meningitis auslösen kann. Der Erreger ist gegen mehrere Antibiotika resistent und ein wichtiger sogenannter Krankenhauskeim.
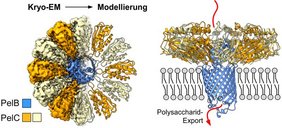
Prof. Kedrov: „Um Biofilme zu bilden, synthetisieren und exportieren Bakterien verschiedene Biopolymere, allen voran Polysaccharide – bestimmte Zuckerketten. Trotz jahrzehntelanger Forschung sind die Kenntnisse, wie die Synthese oder der Transport von statten gehen, noch gering. Wir haben uns auf das Polysaccharid ‚Pel‘ konzentriert, das P. aeruginosa produziert.“
Für die Produktion von Pel ist eine aus mehreren Untereinheiten bestehende Proteinmaschinerie erforderlich, die zwei Membranen durchquert. Kedrov: „Bisher waren aber weder die Struktur der Maschinerie noch deren Dynamik bekannt. Mit Hilfe der Kryo-Elektronenmikroskopie können wir die Struktur des PelBC-Komplexes in den Lipidmembranen auflösen und den Weg des Pel-Polysaccharids identifizieren.“
Marius Benedens, der Erstautor, ergänzt: „Unsere Studie zeigt, wie elektrostatische Wechselwirkungen in der Natur genutzt werden, um den Exportkomplex zusammenzusetzen und den Transport des Polysaccharids zu ermöglichen. Damit die Zelle überlebt, darf die Pore für den Transport jedoch nicht dauerhaft offen vorliegen. Daher ist eine kleine Konformationsänderung am Ende dieser Pore notwendig – dabei öffnet sich gewissermaßen ein winziges Tor.“
Kedrov zu den Anwendungsperspektiven: „Es ist spannend, die Organisation einer komplexen Struktur so detailliert zu sehen. Sie zeigt unter anderem, wie die Natur Herausforderungen im Proteindesign löst, beispielsweise die Kopplung eines symmetrischen Rings von PelC-Untereinheiten an den asymmetrischen PelB-Kanal. Möglicherweise können unsere Ergebnisse genutzt werden, um den Export von Pel gezielt zu blockieren und so die Biofilmbildung zu unterdrücken.“
Im nächsten Schritt will die Arbeitsgruppe diesen Exportvorgang im Detail untersuchen. Zudem soll ein weiterer beteiligter Proteinkomplex näher erforscht werden, der für die Synthese von Pel im Zytoplasma der Zelle und dessen Transport über die innere Membran verantwortlich ist.
(Heinrich-Heine-Universität Düsseldorf)
Originalpublikation:
Marius Benedens, Cristian Rosales-Hernandez, Sabine A. P. Straathof, Jennifer Loschwitz, Otto Berninghausen, Giovanni Maglia, Roland Beckmann & Alexej Kedrov. Assembly and the gating mechanism of the Pel exopolysaccharide export complex PelBC of Pseudomonas aeruginosa. Nature Communications 16:5249 (2025).
DOI: 10.1038/s41467-025-60605-8