Chlamydien infizieren menschliche und tierische Wirtszellen. C. pneumoniae beispielsweise wird durch Tröpfcheninfektion übertragen und befällt die Atemwege. Die Folge: Bronchitis, Asthma oder Lungenentzündung. Die Erreger werden aber auch mit Folgeerkrankungen wie der Alzheimer-Demenz, dem Reitersyndrom, Arteriosklerose und Lungenkrebs in Verbindung gebracht.
An der HHU haben die Arbeitsgruppe von Sen.-Prof. Dr. Johannes H. Hegemann am Institut für Funktionelle Genomforschung der Mikroorganismen zusammen mit dem Center for Structural Studies (CSS), dem Center for Advanced Imaging (CAi) und dem Institut für Biochemie und Molekularbiologie II der Medizinischen Fakultät (Arbeitsgruppe Prof. Dr. Reza Ahmadian) die Infektionsmechanismen des Bakteriums erforscht. Erstmals beschreiben die Forschenden die strukturellen und funktionellen Methoden, die C. pneumoniae nutzt, um in die menschliche Zelle einzudringen: Es ahmt molekulare Strukturen der menschlichen Zelle nach (sogenanntes „molekulare Mimikry“) und nutzt diese für ihren Angriff.
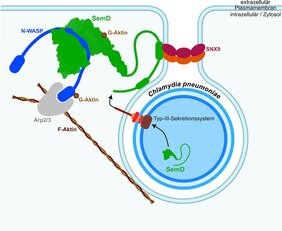
Denn das Bakterium kann sich nur im Inneren einer Wirtszelle vermehren. Und dafür muss es die Transportmaschinerie der Zelle, die sogenannte Endozytose, dazu bringen, es in die Zelle zu transportieren. Um einen Stoff von außen in die Zelle zu bringen, stülpt sich bei der Endozytose die Zellmembran nach innen, nimmt die zu transportierenden kleinen Stoffe in sich auf und schnürt sich anschließend innerhalb der Zelle ab. Es entsteht dann in der Zelle ein membranumschlossenes Vesikel, das den aufzunehmenden Inhalt enthält.
Entscheidend bei dem Vorgang ist das innere sogenannte Aktinzytoskelett der Zelle, das die für die Endozytose notwendige Kraft liefert. Der Vorgang wird aktiviert, indem das menschliche Protein Cdc42 an einen bestimmten Aktivator (N-WASP) koppelt.
Erstautorin Fabienne Kocher, Biologiedoktorandin und Mitglied der Manchot Graduiertenschule „Molecules of Infection IV“, erläutert, wie C. pneumoniae die Endozytose für ihre Zwecke anpasst: „Nachdem der Erreger von außen an die Humanzelle angedockt hat, injiziert er das chlamydiale Protein ‚SemD‘ in die zukünftige Wirtszelle. Das aufgenommene SemD bindet dann von innen an die Membran des sich bildenden Vesikels und aktiviert seinerseits das Aktinzytoskelett, um so die Plasmamembran vollständig um das große Chlamydium zu stülpen.“
Hiermit wird die Endozytose zugunsten des Bakteriums verändert: Diese ist normalerweise nicht dafür ausgelegt, so große Strukturen wie ein ganzes Bakterium zu transportieren.
Prof. Hegemann, der Korrespondenzautor der Studie: „Wir wollten wissen, wie die verschiedenen molekularen Strukturen miteinander interagieren und wie sich die Chlamydien entwickelt haben, um die menschliche Zelle möglichst gut infizieren zu können. Das bakterielle Protein SemD ist tatsächlich optimal an N-WASP angepasst. Es sieht an der entscheidenden Stelle, mit der es an N-WASP bindet, genauso aus wie Cdc42. Es bindet sogar besser als der normale Aktivator Cdc42.“
Prof. Ahmadian von der Medizinischen Fakultät, ergänzt: „Wir konnten auch zeigen, dass SemD sogar Cdc42 verdrängt, welches bereits an N-WASP gebunden hat, um dann selbst daran binden.“
Die Forschenden haben für die Strukturaufklärung winzige Kristalle aus SemD mit N-WASP gezüchtet und dessen Struktur untersucht. Hierfür war das Team von Prof. Dr. Sander Smits am CSS zuständig: „Um diese komplexen Messungen durchführen zu können, ist modernstes technisches Equipment und vor allem das entsprechende Personal notwendig. Diese Konzentration von infrastruktureller Ausstattung und personeller Expertise ist nicht in jedem Labor möglich. Hierfür bedarf es spezieller Zentren, wie die HHU eines mit dem CSS aufgebaut hat.“
Fabienne Kocher zu den weiteren Perspektiven: „Wir hoffen, zukünftig Wirkstoffe zu entwickeln, die diese hochspezifische Interaktion des bakteriellen mit dem menschlichen Protein verhindern. Dies kann dann Infektionen mit C. pneumoniae blockieren.“
Heinrich-Heine-Universität Düsseldorf
Originalpublikation:
Kocher, F., Applegate, V., Reiners, J. et al. The Chlamydia pneumoniae effector SemD exploits its host’s endocytic machinery by structural and functional mimicry. Nat Commun15, 7294 (2024). doi.org/10.1038/s41467-024-51681-3