Obwohl durch Millionen von Jahren der Evolution getrennt, haben Pflanzen und Tiere unabhängig voneinander ähnliche Immunstrategien entwickelt, um sich gegen mikrobielle Infektionen zu schützen. Bei beiden Reichen bilden Immunrezeptoren, die als Nukleotid-bindende/Leucin-reiche Wiederholungsproteine (NLR-Proteine) bezeichnet werden, eine wichtige Verteidigungsschicht innerhalb der Zellen gegen den Angriff von Krankheitserregern. NLRs sind komplexe Vorrichtungen, die aus mehreren Modulen bestehen. Diese Module erkennen die Moleküle (Effektoren) von eindringenden Mikroben. Effektoren lösen die Immunreaktion der Pflanze aus, sie aktivieren die Rezeptoren, Resistenz und Zelltodwege, um die Infektion zu begrenzen. Basierend auf unterschiedlichen Struktur- und Signalmerkmalen werden pflanzliche NLRs in zwei Hauptklassen eingeteilt: solche, die Coiled-coiled (CC)-Module (CNL-Proteine) enthalten, und solche, die Toll/Interleukin-1-Rezeptor/Resistenz (TIR)-Module (TNL-Proteine) enthalten.
Die Wissenschaftler und Wissenschaftlerinnen führten ihre Forschungen am Modellorganismus Arabidopsis thaliana, der Acker-Schmalwand, durch. Jijie Chai ermittelte gemeinsam mit der MPIPZ Forschungsgruppenleiterin Jane Parker und dem Leiter des MPIPZ, Paul Schulze-Lefert, die strukturellen und biochemischen Merkmale, die der Aktivierung eines bestimmten Rezeptors zugrunde liegen: des sogenannten TNL-Typ NLR Rezeptors von Peronospora parasitica 1 (RPP1). Er schützt die Modellpflanze vor einer Infektion durch den Pilz Hyaloperonospora arabidopsidis (Hpa).
Um auf molekularer Ebene zu verstehen, wie RPP1 Pflanzen vor einer Hpa-Infektion schützt, erzeugte das Team RPP1-Protein zusammen mit einem bekannten Hpa-Effektor-ATR1-Protein. Der auf diese Weise aktivierte RPP1-Rezeptor ist ein Enzym, das Nicotinamid-Adenin-Dinucleotid (NAD+) abbaut, was für die Abwehrsignalwegewichtig ist.
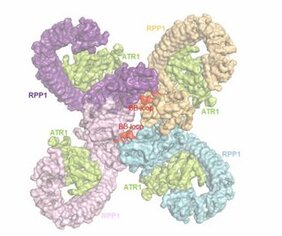
Indem sie RPP1-ATR1-Komplexe isolierten und sie der Kryo-Elektronenmikroskopie unterzogen, haben die Autoren zwei offene Fragen der NLR-Biologie beantwortet: erstens, wie die direkte Bindung des Effektors am NLR-Rezeptor die Aktivierung eines Rezeptors induziert. Zweitens ermittelten sie, dass der TNL-Rezeptor sich in diesem Fall als sogenanntes Tetramer organisiert, ein Molekül, das aus vier dicht gepackten Rezeptormolekülen besteht. Tetramere gehören zu der Gruppe von oligomeren Molekülen, die alle strukturell aus gleichartigen Teilen aufgebaut sind. Das beobachtete Tetramer schafft eine einzigartige Oberfläche innerhalb eines Teils des Rezeptors, die für die Spaltung von NAD+ zur Auslösung von Abwehrsignalen notwendig ist.
Der Effektor ATR1 induziert dabei an einem Ende von RPP1 die Tetramerisierung und zwingt gleichzeitig am entgegengesetzten Ende des Moleküls die oben genannten vier TIR-Module, zwei asymmetrische TIR-Paare zu bilden, die NAD+-abbauen.
Auffallend ist, dass die Ergebnisse aus den Gruppen von Eva Nogales und Brian Staskawicz an der Universität von Kalifornien, Berkeley, zu einem anderen NLR vom TNL-Typ, Roq1 vom Tabak-Verwandten Nicotiana benthamiana, ebenfalls zeigen, dass die TNL-Aktivierung die direkte Effektorerkennung und die Annahme einer ähnlichen tetramerischen Struktur beinhaltet. Der von Roq1 erkannte Effektor wird von einem bakteriellen Pathogen produziert, und der aktivierte Roq1-Rezeptorkomplex sorgt für Resistenz gegen bakterielle Infektionen. Daher scheinen die Entdeckungen von Jijie Chai, seinem Team und der MPIPZ-Forscher von großer Bedeutung für das Verständnis zu sein, wie diese kritischen pflanzlichen Immunmoleküle ihre Wirte vor Infektionen schützen. Allgemeiner gesagt ähneln die oligomeren Konfigurationen, die aktive RPP1 und Roq1 annehmen, den induzierten oligomeren Gerüsten anderer NLR-Rezeptorproteine von Pflanzen und Säugetieren, einschließlich menschlicher Rezeptoren des angeborenen Immunsystems. Dies legt nahe, dass diese Rezeptoren auf einem gemeinsamen Strukturprinzip beruhen, um intrazelluläre Immunsignale und den Zelltod in verschiedenen Reichen des Lebens auszulösen.
Universität Köln
Originalpublikation:
Shoucai Ma, Dmitry Lapin, Li Liu, Yue Sun, Wen Song, Xiaoxiao Zhang, Elke Logemann, Dongli Yu, Jia Wang, Jan Jirschitzka, Zhifu Han, Paul Schulze-Lefert, Jane E. Parker, Jijie Chai: Direct pathogen-induced assembly of an NLR immune receptor complex to form a holoenzyme, Science04 Dec 2020