Mit einer Vielzahl von Techniken, darunter Kryo-Elektronenmikroskopie (Kryo-EM) und Molekulardynamik- Simulationen, haben die Forschenden den Mechanismus der Phosphatfreisetzung aus Aktinfilamenten in bisher unerreichter molekularer Genauigkeit aufgeklärt. Sie beschrieben auch, wie eine „verzogene Hintertür“ die schnellere Freisetzung von Phosphat aus einer Aktin-Mutante ermöglicht, die mit Nemalin-Myopathie, einer schweren Muskelerkrankung, in Verbindung gebracht wird. Die Studie ebnet den Weg für weitere Forschungen zum dynamischen Aktin-Aufbauzyklus in Zellen und zu Krankheiten, die mit einer fehlerhaften Aktin-Organisation zusammenhängen.
Der mysteriöse Austritt von Phosphat
In eukaryotischen Zellen schließen sich Aktin-Proteine zu Filamenten zusammen, d.h. sie polymerisieren. Sie bilden einen Teil des Zytoskeletts: ein kompliziertes, die Zelle stützendes Netzwerk. Der Abbau alter Filamente ist entscheidend für die Zellbewegung und wird durch die ATP-Hydrolyse reguliert – die Reaktion von ATP mit Wasser, die eine Phosphatgruppe spaltet und Energie erzeugt. Die Phosphatfreisetzung aus dem Filamentkern ist das konkrete Signal an die Zelle, dass das Aktinfilament alt genug ist und in Aktin-Untereinheiten zerlegt werden kann. "Der Mechanismus der Phosphatfreisetzung aus Aktinfilamenten war jahrzehntelang ein Rätsel", sagt Wout Oosterheert, Post-Doktorand in der Gruppe um Stefan Raunser am MPI Dortmund und Erstautor der Studie.
Die neuen Ergebnisse bauen auf früheren Forschungsarbeiten der Raunser-Gruppe zu Aktin auf, die in den Jahren 2015, 2018 und 2022 zu bahnbrechenden Veröffentlichungen auf diesem Gebiet führten. In letzterer bestimmte das Raunser-Team hochaufgelöste Kryo-EM-Strukturen von Aktinfilamenten in drei verschiedenen Zuständen: gebunden an ATP, gebunden an ADP in Gegenwart des abgespaltenen Phosphats und gebunden an ADP nach Freisetzung des Phosphats. In keiner der Strukturen gab es jedoch eine Öffnung oder Tür im Aktin, durch die das Phosphat aus dem Filament hätte entweichen können. "Daher vermuteten wir, dass es eine Hintertür geben müsse, die sich ganz kurz öffnet, um das Phosphat freizusetzen, und sich dann schnell wieder schließt", sagt Raunser.
Ein multidisziplinärer Ansatz
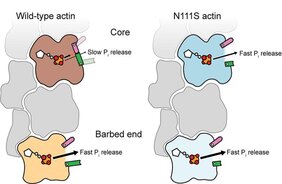
Die Max-Planck-Forschenden gingen das Problem nun von verschiedenen Seiten an. Da bekannt war, dass Phosphat am Ende des Filaments, dem sogenannten „barbed end“, sehr schnell aus Aktin freigesetzt wird, bestimmten Raunser und sein Team dessen Struktur mittels Kryo-EM. Und tatsächlich fanden sie dort eine offene molekulare Hintertür, was die sehr schnelle Phosphatfreisetzung erklärt. Unklar war allerdings noch, wie das Phosphat aus den Aktin-Untereinheiten im Filamentkern entweicht. Hier kam die Expertise der Gruppe um Gerhard Hummer vom MPI Frankfurt ins Spiel: Die Forschenden nutzten die Strukturdaten aus dem Jahr 2022, um molekulardynamische Simulationen durchzuführen und mögliche Austrittswege für das Phosphat aus dem Filamentkern vorherzusagen. Um die möglichen Routen zu validieren, wurden Aktin-Mutanten vom Team um Peter Bieling (MPI Dortmund) hergestellt, die den Schließmechanismus der Hintertür stören können. Die Forschenden erfassten, wie schnell die Mutanten das Phosphat freisetzen, und bestimmten schließlich die hochauflösenden Kryo-EM-Strukturen der "schnellsten" Kandidaten.
Die Mutationsanalyse ergab, dass das Phosphat den gleichen Freisetzungsweg im Filamentende und im -kern nimmt. Die Strukturen und Wechselwirkungen im Kern benötigen jedoch zusätzliche Umgestaltungen, was das Öffnen der Tür erschwert. Nach der Phosphatabspaltung bleibt die Hintertür überwiegend geschlossen (durchschnittlich 100 Sekunden), bevor sie sich für weniger als eine Sekunde öffnet, um das Phosphat entweichen zu lassen. "Das erklärt, warum wir in unseren Kryo-EM-Daten von 2022 keine offene Hintertür gesehen haben", sagt Raunser.
Die Aktin-Saga – Fortsetzung folgt …
Besonders die untersuchte Aktin-Mutante mit der Bezeichnung N111S hat die Aufmerksamkeit der Max-Planck-Forschenden auf sich gezogen, denn sie steht im Zusammenhang mit der Muskelerkrankung Nemalin-Myopathie. Die Hintertür in dieser Mutante steht immer offen und setzt daher viel schneller Phosphat frei als normales Wildtyp-Aktin. "Wir vermuten, dass diese ultraschnelle Freisetzung zum Krankheitsbild beitragen kann", sagt Oosterheert.
In einem möglichen nächsten Schritt wollen die Max-Planck-Forschenden nun herausfinden, wie die Phosphatfreisetzung innerhalb der Zelle gesteuert wird und welche Rolle die an Aktin bindenden Proteine dabei spielen. Darüber hinaus ermöglicht ihre Arbeit die Untersuchung weiterer krankheitsrelevanter Aktin-Mutationen – ein Ansatz, der letztlich zur Entwicklung neuer Therapiestrategien für Muskelerkrankungen beitragen könnte.
MPI für molekulare Physiologie
Originalpublikation:
Oosterheert, W., Blanc, F.E.C., Roy, A. et al. Molecular mechanisms of inorganic-phosphate release from the core and barbed end of actin filaments. Nat Struct Mol Biol (2023). doi.org/10.1038/s41594-023-01101-9