Während sich Zellen in den meisten körpereigenen Geweben regelmäßig erneuern, bleibt die Zahl an Nervenzellen im menschlichen Gehirn oder Rückenmark konstant. Zwar können sich Nervenzellen auch im Gehirn erwachsener Säugetiere neu bilden, wie die LMU-Wissenschaftlerin Professor Dr. Magdalena Götz früher gezeigt hat. Allerdings gelingt es jungen Neuronen nach Gehirnverletzungen nicht, sich außerhalb zweier bestimmter Gehirnbereiche in bereits bestehende neuronale Netzwerke zu integrieren und zu überleben. Das scheint an Gliazellen zu liegen, die das Stützgewebe im Gehirn bilden. Speziell Mikroglia lösen Entzündungen aus und führen zu Narben, die die verletzte Stelle abschirmen. Wie der Körper solche Mechanismen reguliert, war bislang unbekannt.
Jetzt zeigt ein Team um den LMU-Zellbiologen Prof. Jovica Ninkovic in Nature Neuroscience, dass die Verringerung der Reaktivität von Mikroglia entscheidend ist, um chronische Entzündungen und Gewebenarben zu verhindern, und so die Regenerationsfähigkeit zu verbessern.
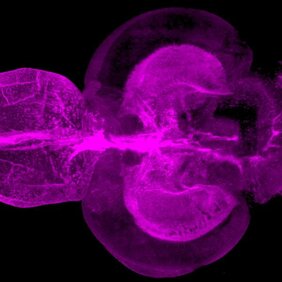
Wie ZNS-Verletzungen im Zebrafisch heilen
Im Gegensatz zu Säugetieren ist das Zentralnervensystem (ZNS) von Zebrafischen außergewöhnlich regenerationsfähig. Bei Verletzungen entstehen unter anderem langlebige Neuronen aus neuralen Stammzellen. Darüber hinaus führen ZNS-Verletzungen bei Zebrafischen nur zu einer vorübergehenden Reaktivität von Gliazellen, was die Integration von Nervenzellen in verletzten Regionen des Gewebes erleichtert. „Die Idee war, Unterschiede zwischen Zebrafischen und Säugetieren herauszuarbeiten, um zu verstehen, welche Signalwege im menschlichen Gehirn die Regeneration hemmen – und wie wir hier vielleicht eingreifen können“, sagt Ninkovic.
Die Wissenschaftlerinnen und Wissenschaftler erzeugten gezielt ZNS-Läsionen in Zebrafischen, worauf Mikroglia aktiviert wurden. Gleichzeitig fanden die Forschenden in den Läsionen eine Ansammlung von Lipidtropfen und von TDP-43-haltigen Strukturen. Bislang wurde das Protein TDP-43 vor allem mit neurodegenerativen Erkrankungen in Verbindung gebracht.
Im Zebrafisch-Modell spielte weiterhin Granulin eine wichtige Rolle. Dieses Protein trug dazu bei, die Lipidtröpfchen und TDP-43-haltigen Strukturen zu beseitigen, worauf die Mikroglia von der aktivierten Form in die Ruheform übergingen. Es kam zur narbenlosen Regeneration der Verletzung. Zebrafische mit experimentell erzeugtem Granulinmangel hingegen zeigten eine ähnlich schlechte Regeneration der Verletzung wie Säugetiere. „Wir gehen deshalb davon aus, dass Granulin eine wichtige Rolle bei der Regeneration von Nerven im Zebrafisch spielt“, sagt Ninkovic.
Von der Grundlagenforschung zur Anwendung
Um den Vergleich zwischen Menschen und Zebrafischen weiterzuführen, hat Ninkovics Team Material von Patientinnen und Patienten, die aufgrund von Gehirnverletzungen verstorben waren, untersucht. Auch hier korrelierte das Ausmaß der Mikroglia-Aktivierung mit der Ansammlung von Lipidtröpfchen und TDP-43-haltigen Strukturen. Die entsprechenden Signalwege im humanen Gewebe waren also mit Zebrafischen vergleichbar.
Darin stecke „Potenzial für neue therapeutische Anwendungen beim Menschen“, erklärt der LMU-Forscher. Er plant, im nächsten Schritt zu untersuchen, ob sich bekannte niedermolekulare Verbindungen eignen, um Signalwege der Mikroglia-Aktivierung zu hemmen und damit die Heilung neuraler Läsionen zu fördern. Auch in dieser sogenannten präklinischen Phase sollen Zebrafisch-Modelle zum Einsatz kommen.
Ludwig-Maximilians-Universität
Originalpublikation:
Zambusi, A., Novoselc, K.T., Hutten, S. et al. TDP-43 condensates and lipid droplets regulate the reactivity of microglia and regeneration after traumatic brain injury. Nat Neurosci (2022). doi.org/10.1038/s41593-022-01199-y