Wissenschaftler vom Max-Planck-Institut für Entwicklungsbiologie in Tübingen haben nun einen entscheidenden Faktor ausgemacht, der dafür sorgt, dass Boten-RNA abgefangen und für eine spätere Verwendung erhalten bleibt. Damit haben sie einen Schlüsselmechanismus entdeckt, der nicht nur erklären kann, wie es gelingt, dass etwa Eizellen oder Nervenzellen in einem bestimmten Entwicklungsstadium verharren, bis sie gebraucht werden. Möglicherweise liegt hier auch ein Grund für die vorzeitige Ovarialinsuffizienz verborgen.
Die Eizellen im weiblichen Körper werden bereits bei der Geburt angelegt. Doch sie entwickeln sich nur bis zu einem bestimmten Punkt. Erst in der Pubertät beginnen sie zu einer befruchtungsfähigen Eizelle heranzureifen – Eisprung für Eisprung, eine nach der anderen. Dafür müssen sie in einem unreifen Entwicklungsstadium angehalten werden, bis ihr Zeitpunkt gekommen ist.
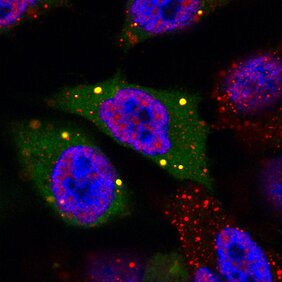
Doch mit welchen Mechanismen gelingt das? Cátia Igreja vom Max-Planck-Institut für Entwicklungsbiologie in Tübingen hat gemeinsam mit ihrem Doktoranden Felix Räsch herausgefunden, dass hierbei ein Protein namens 4E-T eine entscheidende Rolle spielt. Dabei handelt es sich um einen regulierenden Faktor der Proteinbiosynthese, der hier eine neue, überraschende Rolle einnimmt: Er hindert Boten-RNA (mRNA) daran, zu den Ribosomen, den Proteinfabriken der Zelle, zu gelangen und schützt sie gleichzeitig davor, abgebaut zu werden.
Die mRNA ist quasi die Abschrift eines Gens auf dem DNA-Strang und beinhaltet die Bauanleitung für neue Proteine, die in den Ribosomen synthetisiert werden sollen. „RNA ist der wichtigste Schlüsselfaktor, wenn es darum geht, die Proteinproduktion in Zellen zu steuern“, sagt Igreja. „Wir kennen verschiedene Mechanismen, die zum Tragen kommen, wenn bestimmte Proteine nicht mehr hergestellt werden sollen.“ Der naheliegendste Weg ist, die mRNA einfach zu zerstören, so dass die Bauanleitung gar nicht erst an den Ribosomen ankommt.
Doch was, wenn die Bauanleitung zu einem späteren Zeitpunkt nochmals gebraucht wird und dann schnell zur Verfügung stehen soll? Dann ist es vorteilhaft, wenn die mRNA in der Zelle verbleibt, und bis zum Zeitpunkt, an dem sie gebraucht wird, wie eingefroren in der Zelle erstarrt. „Wir wissen, dass bei unreifen Eizellen, die über viele Jahre in der Warteposition verharren, das regulatorische Protein 4E-T eine wichtige Rolle spielt“, sagt Igreja. Mutationen in diesem Protein stehen im Zusammenhang mit vorzeitiger Ovarialinsuffizienz. „Ein weiteres Beispiel sind Nervenzellen, die immer bereit sein müssen, neue Verbindungen zu anderen Nervenzellen auszubilden“, so Igreja. Auch hier spielt 4E-T nachweislich eine Rolle.
4E-T übernimmt verschiedene regulatorische Funktionen bei der Proteinsynthese. „Wir wollten wissen, ob 4E-T möglicherweise auch dafür verantwortlich ist, dass mRNAs in der Zelle eingefroren werden“, sagt Igreja. Tatsächlich zeigte sich in den Experimenten der Tübinger Wissenschaftler, dass 4E-T sich an ein Protein heftet, das entscheidend ist für den Transport der mRNA zu den Ribosomen. Es verhindert dadurch, dass die Bauanleitung an der Proteinfabrik ankommt. Gleichzeitig stabilisiert 4E-T die aufgehaltene Boten-RNA, so dass sie nicht abgebaut wird und zur späteren Verwendung erhalten bleibt.
„4E-T nimmt bei der Proteinsynthese vielfältige Rollen ein“, sagt Igreja. „Jetzt wissen wir, dass dieses regulatorische Protein auch entscheidend daran beteiligt ist, dass mRNA auf dem Weg zu den Ribosomen aufgehalten wird und für einen späteren Zeitpunkt erhalten bleibt.“ Damit leisten die Wissenschaftler nicht nur einen entscheidenden Beitrag zum Verständnis wie die Proteinsynthese reguliert und Zellen wie Ei- oder Nervenzellen in ihrer Entwicklung angehalten werden.
„Unsere Erkenntnis erklärt möglicherweise auch, warum mutiertes 4E-T dazu führen kann, dass betroffene Frauen bereits in relativ jungem Alter unfruchtbar werden“, so Igreja. Von der vorzeitigen Ovarialinsuffizienz, also einer Erschöpfung der Eierstockfunktion vor dem 40. Lebensjahr sind rund 1 bis 2 Prozent aller Frauen betroffen. Die zugrundeliegenden Mechanismen sind bislang nicht geklärt.
Max-Planck-Institut für Entwicklungsbiologie
Originalpublikation:
Räsch, F. Weber, R, Izaurralde E and Cátia Igreja: 4E-T-bound mRNAs are stored in a silenced and deadenylated form. Genes & Dev. 2020. Published in Advance April 30, 2020, doi: 10.1101/gad.336073.119