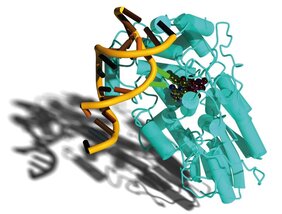
Ultraviolette Strahlung, wie sie im Sonnenlicht vorhanden ist, greift die Erbsubstanz an und bewirkt, dass Schäden an der DNA entstehen. „Am häufigsten kommen Schäden vom so genannten CPD-Typ vor“, erläutert Lars-Oliver Essen von der Philipps-Universität Marburg, einer der Leitautoren der Studie „Dabei handelt es sich um fehlerhafte Verknüpfungen zwischen den Basen der DNA, wodurch die Information des geschädigten DNA-Strangs an diesen Stellen nicht mehr ablesbar ist.“ CPD-Schäden sind die Hauptursache für Sonnenbrand und Hautkrebs beim Menschen.
Aber Licht kann DNA nicht nur zerstören, sondern auch helfen, die entstandenen Fehler zu beseitigen. Photolyase-Enzyme beziehen Energie aus blauem Licht, um die CPD-Schäden auszumerzen, die durch ultraviolette Strahlung entstehen. „Photolyasen bieten fast allen Lebewesen, die der Sonne ausgesetzt sind, einen Schutz gegen UV-Strahlung“, legt der Biochemiker Professor Dr. Ming-Daw Tsai von der Nationalen Taiwanesischen Universität dar, ein weiterer Leitautor.
Essen beschäftigt sich seit langem mit dieser Art von lichtgetriebenen Enzymen: „Schon vor 20 Jahren haben wir zum Beispiel die strukturellen Eigenarten entdeckt, denen Photolyasen ihre ungewöhnlich hohe Effizienz für die DNA-Reparatur verdanken“, sagt der Chemiker.
Technische Durchbrüche der letzten zehn Jahre helfen, die Struktur großer Molekülkomplexe aufzuklären: Einerseits Kryo-Elektronenmikroskopie, andererseits zeitaufgelöste serielle Femtosekunden-Kristallographie. „Der Hauptvorteil der Kryo-EM liegt in ihrer Fähigkeit, sehr große Komplexe hochaufgelöst darzustellen“, erklärt Essen. „Femtosekunden-Kristallographie dagegen ermöglicht es, in Echtzeit zu verfolgen, wie sich die Struktur von lichtempfindlichen Makromolekülen wie den Photolyasen und der an sie gebundenen DNA verändert.“
Essen versammelte Fachleute aus aller Welt, um mithilfe der neuen Verfahren den Mechanismus aufzuklären, mit dem die Photolyase einen CPD-Schaden repariert. „Wir fertigten 18 Schnappschüsse zu verschiedenen Zeitpunkten an, die eine zeitliche Auflösung bis runter in den Bereich von 100 Pikosekunden, also einer zehnmilliardstel Sekunde gewährleisten“, erzählt Essens früherer Mitarbeiter Dr. Manuel Maestre-Reyna, der mittlerweile eine Professur an der Nationalen Taiwanesischen Universität innehat und als Erstautor der Studie firmiert.
„Jetzt sieht man erstmals im Film, wie das DNA-Reparaturenzym eine fehlerhafte Bindung nach der anderen am CPD-Schaden knackt, bevor es sich nach getaner Arbeit wieder von der DNA löst“, führt Essen aus. „Unsere Daten decken nun den vollständigen molekularen Mechanismus eines der am weitesten verbreiteten DNA-Reparatursysteme ab“, betont der Biochemiker. „Die Ergebnisse stellen einen Höhepunkt meiner langjährigen Interessen an DNA-Photolyasen und ihrem Reparaturmechanismus dar.“
Lars-Oliver Essen lehrt Biochemie in Marburg. Neben seiner Arbeitsgruppe und den Kolleginnen und Kollegen aus Taiwan um Maestre-Reyna und Tsai, dem Leiter des Taiwanesischen Proteinprojekts, beteiligten sich zahlreiche Fachleute aus Japan, der Schweiz, Frankreich, den USA sowie Italien an der Studie. Die Deutsche Forschungsgemeinschaft und zahlreiche Förderorganisationen aus Taiwan, Japan und den USA unterstützten die zugrundeliegenden Forschungsarbeiten finanziell.
Universität Marburg
Originalveröffentlichung:
Manuel Maestre-Reyna & al.: Watching the entire DNA repair process by a photolyase at atomic resolution in real time, Science 2023, DOI: 10.1126/science.add7795, www.science.org/doi/10.1126/science.add7795